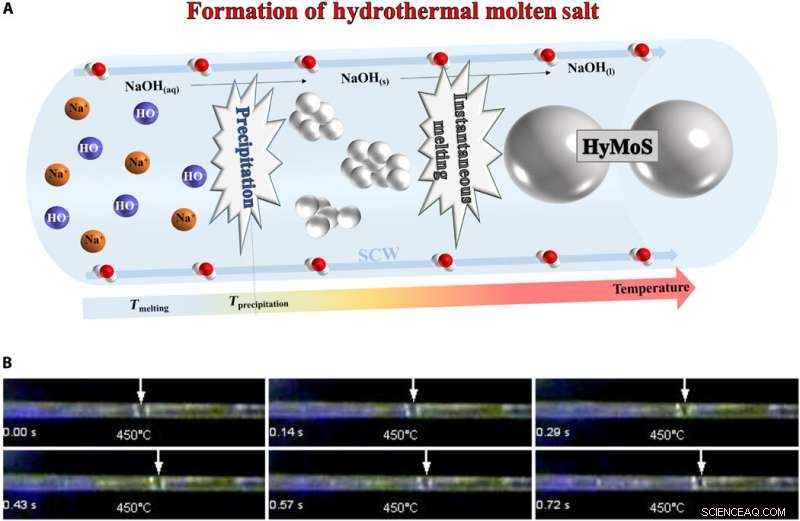
Formazione dell'HyMoS. (A) Schema della formazione dell'HyMoS in SCW, con l'esempio di NaOH. (B) Foto di montaggio dal film S1 (sotto) che mostra l'osservazione diretta e il movimento di una goccia di sale fuso NaOH in un capillare di zaffiro a 25 MPa e 450 ° C. Credito fotografico:Thomas Voisin, ICMCB. Credito:progressi scientifici, doi:10.1126/sciadv.aaz7770
In un nuovo rapporto su Progressi scientifici , T. Voisin e un gruppo di ricerca presso il Centro nazionale di ricerca scientifica e l'Istituto di tecnologia e gestione dell'energia in Francia, proposto un nuovo sistema di solventi. Il sistema idrotermale dei sali fusi (HyMoS), è composto da un sale fuso in acqua pressurizzata ed è in grado di modificare la solubilità degli inorganici nell'acqua supercritica. Gli scienziati hanno utilizzato l'idrossido di sodio (NaOH); un sale a bassa temperatura di fusione, e ha mostrato la capacità di farlo precipitare a una temperatura superiore al suo punto di fusione, per formare istantaneamente HyMoS. Il sale fuso potrebbe quindi sciogliere una grande quantità di sale inorganico compreso il solfato di sodio (Na 2 COSÌ 4 ). Il sistema a solvente apre una nuova strada in diversi campi tra cui la sintesi dei materiali, conversione della biomassa, chimica verde, raccolta differenziata, catalisi e produzione sostenibile. Il lavoro offre opportunità al di là della dinamica idrotermale per studiare la chimica e le intuizioni della precipitazione salina innovativa.
L'acqua supercritica è spesso conosciuta come un solvente "magico", grazie alla sua capacità di dissolvere l'olio. Questa proprietà ha ampliato le potenziali applicazioni di SCW nella sintesi dei materiali, riciclaggio o conversione della biomassa. Però, quando la polarità di SCW si rompe, la solubilità dei composti inorganici diminuisce. La sfida può essere risolta identificando buoni candidati co-solventi con una grande capacità di dissoluzione per composti inorganici insieme a un'elevata stabilità termica, per superare i limiti di SCW. I sali fusi sono una possibilità interessante a causa della loro alta densità e importanti capacità di dissoluzione. I sali fusi sono molto diversi e usati abbondantemente per decenni come sali nitrati, carbonati, idrossidi o miscele eutettiche per sciogliere materiali inorganici. In questo lavoro, Voisin et al. proposto di generare sale fuso all'interno di SCW per superare i limiti di SCW da solo. Hanno composto il sale fuso idrotermale (HyMoS) con un sale di interesse insieme a SCW, per applicazioni idrotermali ad alta temperatura.

Video dell'osservazione di una miscela NaOH-H2O a 25 MPa e 450 °C in un tubo di zaffiro. Il video mostra il movimento della gocciolina di NaOH fusa all'interno del capillare in acqua. Credito:progressi scientifici, doi:10.1126/sciadv.aaz7770
Per la formazione di HyMoS, il team ha iniettato una soluzione omogenea di acqua/sale di elettrolita sotto pressione e l'ha riscaldata per far precipitare il sale. Poiché la temperatura di precipitazione era superiore alla temperatura di fusione, la fusione del sale seguì istantaneamente la precipitazione, per formare HyMoS. Gli scienziati hanno notato l'evoluzione e il movimento di una gocciolina di NaOH fusa in SCW all'interno di un capillare di zaffiro. Quando hanno raffreddato il sistema, potrebbero recuperare l'iniziale soluzione elettrolitica omogenea acqua/sale, poiché il meccanismo era completamente reversibile. Voisin et al. selezionato il sale NaOH per la sua elevata stabilità termica e bassa temperatura di fusione (318 0 C) ed elevata capacità di sciogliere sali inorganici.
Il team ha utilizzato una configurazione sperimentale, dettagliata altrove, misurare i valori di solubilità e studiare il comportamento dell'idrossido di sodio in SCW. Hanno esplorato la differenza di densità e viscosità tra i due componenti per misurare la solubilità del composto in condizioni SCW. Il meccanismo in due fasi della precipitazione solida era veloce, e non sono state osservate particelle solide nell'apparecchiatura capillare in zaffiro dotata di una fotocamera convenzionale con dispositivo ad accoppiamento di carica a 50 fotogrammi al secondo. I risultati hanno dimostrato la fattibilità della creazione di un denso co-solvente che scorre insieme a SCW. Il team si è quindi concentrato sulla capacità dell'NaOH di dissolvere altri sali inorganici in condizioni SCW.
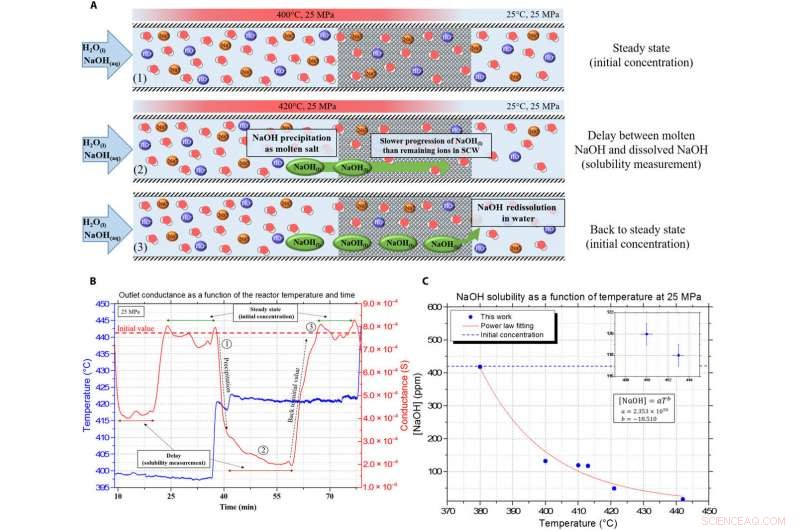
Presentazione dei dati di conducibilità continua e del ritardo, utilizzato per misurare la solubilità del sale fuso di NaOH. (A) Illustrazione del principio di misurazione utilizzando l'analisi del ritardo a causa delle differenze di viscosità e densità nei mezzi porosi tra NaOH e SCW. (B) Esempio della misura continua ottenuta con il principio del ritardo, con la curva blu come la temperatura all'interno del reattore e la linea rossa come misura di conduttanza all'uscita (corretta dal ritardo). (C) Curva di solubilità di NaOH risultante in SCW a 25 MPa. Credito:progressi scientifici, doi:10.1126/sciadv.aaz7770
Per evidenziare la capacità di HyMoS a base di NaOH di dissolvere un sale solido in SCW, il team ha proposto un diverso protocollo sperimentale. Durante l'esperimento, hanno prima iniettato una soluzione acquosa del sale inorganico solfato di sodio (Na 2 COSÌ 4 ) nel sistema ad una data temperatura per depositare il sale solido sulla parete del reagente. Poiché Voisin et al. conosceva la solubilità del Na 2 COSÌ 4, hanno verificato se si sono verificate precipitazioni nel sistema durante le misurazioni continue della conducibilità. Gli scienziati hanno calcolato la concentrazione di solfato di sodio nella soluzione di idrossido di sodio. Sebbene l'aumento della temperatura nella configurazione abbia avuto poca influenza sul solfato di sodio del sale inorganico, la concentrazione iniziale del sale fuso idrossido di sodio era una grande influenza sulla sua velocità di dissoluzione. Logicamente, quindi, all'aumentare della concentrazione di idrossido di sodio, anche la sua corrispondente fase fusa è aumentata nel setup, causando velocità di dissoluzione più elevate dei sali inorganici depositati nel reattore per garantire un flusso continuo.
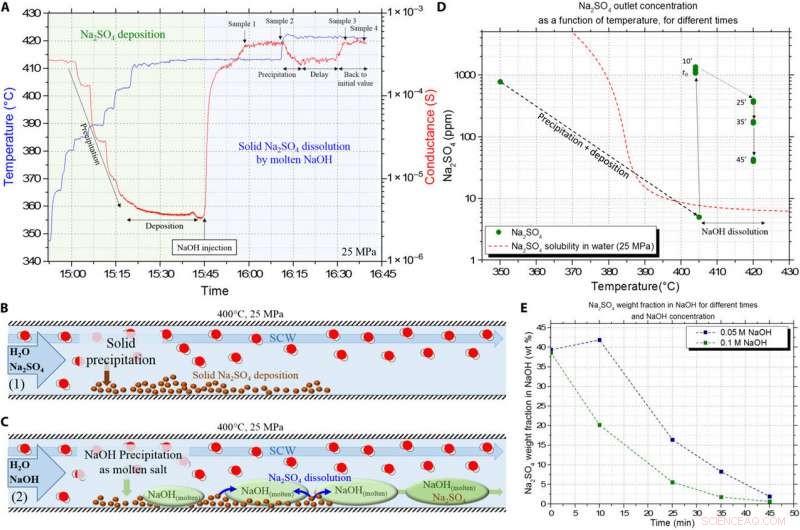
Validazione della dissoluzione del sale solido Na2SO4 depositato da parte dell'NaOH HyMoS in SCW in flusso continuo. (A) Segnali grezzi di conduttanza (in rosso) e temperatura (in blu) ottenuti dal setup sperimentale, che mostra le diverse fasi del protocollo. La zona verde rappresenta la precipitazione di Na2SO4 e la fase di deposizione del sale nel reattore, e la zona blu rappresenta l'iniezione di soluzione di NaOH per dissolvere il sale depositato. (B) Schema che illustra la prima fase dell'esperimento consistente nella deposizione di sale per precipitazione. (C) Schema che illustra la seconda fase dell'esperimento, con precipitazione/scioglimento di NaOH e dissoluzione del Na2SO4 precedentemente depositato. (D) La concentrazione di Na2SO4 ICP risulta in base alla temperatura, per tempi diversi durante la dissoluzione da parte di NaOH. Confronto tra le misure e la normale solubilità di Na2SO4 in SCW. (E) Evoluzione della frazione di massa Na2SO4 nella fase fusa NaOH nel tempo, per due diverse concentrazioni di alimentazione di NaOH. Credito:progressi scientifici, doi:10.1126/sciadv.aaz7770
In questo modo, T. Voisin e colleghi hanno osservato il sale fuso in SCW per affrontare le sfide esistenti con le tecnologie a base di fluidi supercritici. Usando un sale idrossido fuso stabile come l'idrossido di sodio hanno generato un solvente in situ per dissolvere una grande quantità del sale solido di solfato di sodio. Gli scienziati hanno dimostrato la prima applicazione di HyMoS e hanno bypassato la deposizione di sale e l'ostruzione nei reattori per sviluppare processi a flusso continuo. La tecnica è conveniente, poiché i sali basici come NaOH utilizzati negli esperimenti sono materiali relativamente economici, rispetto ai liquidi ionici complessi. La capacità di generare un solvente denso con un sistema semplice ed economico ha un impatto anche sui sistemi idrotermali. I sali fusi sono, però, limitato rispetto alla processabilità per i sistemi continui a causa dell'alta temperatura e dell'elevata viscosità richieste nei sistemi batch. Il sistema HyMoS bifasico è composto da SCW e da un sale fuso, e la configurazione può essere esplorata come un nuovo tipo di emulsione idrotermale acqua/sale per dissolvere efficacemente una varietà di sali diversi.
© 2020 Scienza X Rete