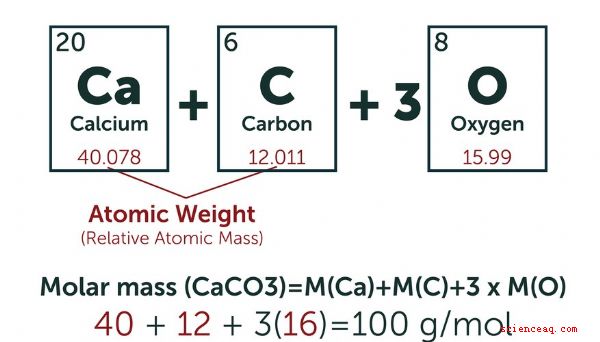
Semplicemente ai loro calcoli, i chimici hanno creato un'unità standard per il numero di atomi di un particolare composto coinvolto in una reazione o in qualche altro processo chimico. Definiscono una mole (mol) come la quantità di qualsiasi sostanza che abbia lo stesso numero di unità fondamentali di 12 grammi di carbonio-12, che è il numero di Avogadro (6.022 × 10 23). Il sistema di misura SI (metrico) definisce un millimole (Mmol) come un millesimo di una talpa. Di solito calcoli il numero di moli di una sostanza pesando la quantità che hai a disposizione. Se vuoi convertire in Mmol, moltiplica per 10 3 (1.000). TL; DR (Troppo lungo, non letto) Una talpa è uguale al numero di Avogadro di particelle di un particolare composto. Un millimole (Mmol) è un millesimo di una talpa. Come calcolare le talpe Le masse atomiche sono misurate in unità di massa atomica (AMU). Una AMU è esattamente 1/12 della massa del nucleo di un atomo di carbonio 12 nel suo stato fondamentale. Una mole di una sostanza è definita uguale al numero di particelle di Avogadro di quella sostanza. Secondo questa definizione, il peso di una mole di una sostanza in grammi è lo stesso numero del peso di una singola particella di tale sostanza nell'AMU. Ad esempio, il peso atomico del carbonio-12 è di 12 AMU, quindi una mole di carbonio-12 pesa 12 grammi. Considera un contenitore pieno di gas idrogeno (H 2). Ogni particella nel contenitore è una molecola composta da due atomi di idrogeno, quindi è necessario conoscere solo la massa atomica dell'idrogeno per calcolare il peso molecolare. La maggior parte delle versioni della tabella periodica elenca la massa atomica di ciascun elemento sotto il suo simbolo. Per l'idrogeno, che ha un singolo protone nel suo nucleo, è 1.008 AMU, che è una media di tutti gli isotopi naturali dell'idrogeno. Di conseguenza, la massa atomica dell'idrogeno è di 2.016 AMU e una mole di gas di idrogeno pesa 2.016 grammi. Per trovare il numero di moli nel campione, pesare il campione in grammi e dividerlo per il peso molecolare del gas idrogeno in grammi. Ad esempio, un campione del peso di 15 grammi di gas idrogeno puro contiene 7,44 moli. Conversione in Mmol A volte le quantità sotto inchiesta sono così piccole che la loro espressione in talpe è ingombrante. Inserisci il millimole. Moltiplicando il numero di moli per mille, è possibile convertire un numero molto piccolo in uno più gestibile. Ciò è particolarmente utile quando si tratta di unità di volume nell'ordine dei millilitri. 1 mol = 1.000 Mmol Concentrazione della soluzione I chimici usano la molarità come misura della concentrazione di un particolare composto in soluzione. Definiscono la molarità come il numero di moli per litro. Converti la molarità in millimolarità moltiplicando per 1.000. Ad esempio, una soluzione di 1 mol (molare, anche detta M) ha una concentrazione di 1 mole per litro. Ciò equivale a una soluzione di 1.000 Mmol (millimolare, anche a volte scritta come mM), che è una che contiene 1.000 Mmol per litro. Esempio Una soluzione contiene 0,15 grammi di carbonato di calcio. Quanti millimoli è? La formula chimica del carbonato di calcio è CaCO 3. Il peso atomico del carbonio (C) è di circa 12 AMU, quello dell'ossigeno (O) di circa 16 AMU e quello del calcio (Ca) di circa 40 AMU. Ogni molecola di carbonato di calcio pesa quindi 100 AMU, il che significa che una mole pesa circa 100 grammi. Un peso di 0,15 grammi rappresenta 0,15 g ÷ 100 g /mol = 0,0015 moli. Questo è equivalente a 1,5 Mmol. Qual è la molarità e la millimolarità di questo molto carbonato di calcio in 2,5 litri di soluzione? La molitoria è definita come il numero di moli per litro, quindi dividi il numero di moli per 2,5 per ottenere la molarità: 0.0015 ÷ 2.5 = 0.0006 M Moltiplicare per 1.000 per ottenere la millimolarità = 0.6 mM Si noti che si ottiene lo stesso risultato per millimolarità se si divide il numero di millimetri per il volume della soluzione.