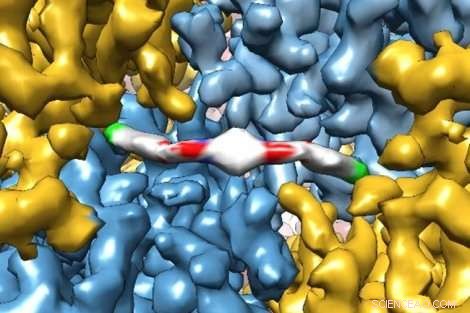
Un'innovativa immagine di microscopia crioelettronica mostra in modo estremamente dettagliato come una nuova molecola terapeutica interagisce con una proteina, fornendo ai ricercatori approfondimenti su come funziona nel corpo umano. La molecola, ISRIB, è stato dimostrato in un recente studio di Peter Walter della UCSF, dottorato di ricerca, e Susanna Rosi, dottorato di ricerca, per ripristinare l'insufficienza di memoria nei pazienti con trauma cranico. Credito:Adam Frost Lab
I ricercatori della UC San Francisco hanno recentemente catturato immagini squisite di una proteina catturata nell'atto di legarsi a un nuovo farmaco terapeutico con una risoluzione sufficiente per modellare come i singoli atomi della proteina e del farmaco si sono allineati.
Fino a poco tempo fa, un'impresa del genere sarebbe stata considerata impossibile, ma negli ultimi cinque anni, tali scoperte sono diventate quasi all'ordine del giorno qui, parte di una rivoluzione della risoluzione guidata dai ricercatori dell'UCSF.
Grazie ai loro recenti progressi nella microscopia crioelettronica (crio-EM) - una tecnica i cui inventori sono stati insigniti del Premio Nobel per la Chimica 2017 - questi ricercatori hanno consentito rapidi progressi nella ricerca di terapie più precise e potenti per un'ampia gamma di malattie umane.
Le proteine sono minuscole macchine molecolari che alimentano tutto ciò che fanno le nostre cellule e sono anche gli obiettivi primari dei farmaci. Scoprire come funzionano le nuove proteine potrebbe portare a terapie salvavita per il cancro o nuovi antidolorifici con meno pericolo di dipendenza.
Ma per capire veramente come funzionano le proteine, i ricercatori devono essere in grado di visualizzarli su scala atomica. In precedenza, ciò richiedeva una faticosa crescita dei cristalli di una proteina - un processo che potrebbe richiedere anni per ottenere il risultato corretto - quindi l'emissione di raggi X attraverso i cristalli per calcolare la composizione atomica della proteina. Sfortunatamente, molte delle proteine e dei complessi più interessanti non possono essere cristallizzati.
Cryo-EM esiste dagli anni '70, ma dal 2013 i progressi tecnici sono stati introdotti in parte da David Agard della UCSF, dottorato di ricerca, e Yifan Cheng, dottorato di ricerca, hanno notevolmente migliorato la capacità del cryo-EM di risolvere sia la più piccola che la più complessa delle proteine con dettagli sorprendenti, trasformando il microscopio elettronico da un vecchio cavallo di battaglia del retro del laboratorio alla più recente superstar scientifica quasi da un giorno all'altro.
Questo rinascimento crio-EM è stato stimolato dagli sforzi di Agard e Cheng per sviluppare hardware e software per fotocamere in grado di rilevare singoli elettroni - un obiettivo che era stato a lungo considerato impraticabile dal campo, ma che il duo ha realizzato riunendo scienziati e ingegneri alla UCSF, Laboratorio Nazionale Lawrence Berkeley, e Gatan, un piacevole, California, azienda che produce telecamere EM.
"Non molto tempo fa l'intero campo pensava che contare i singoli elettroni non avrebbe mai funzionato, " Cheng ricorda. "Ma alla UCSF, la cultura ci incoraggia a fare cose che tutti gli altri pensano siano impossibili".
Nonostante lo scetticismo di molti loro coetanei, Agard e Cheng, entrambi professori di biochimica e biofisica presso l'UCSF e ricercatori dell'Howard Hughes Medical Institute, hanno riconosciuto che la cattura di singoli elettroni era fondamentale per la capacità dei microscopi elettronici di risolvere le proteine biologiche chiave in modo sufficientemente dettagliato da consentire agli scienziati di comprenderne la funzione.
Un'illustrazione mostra le immagini crio-EM possibili prima del 2013 all'estrema sinistra e le immagini crio-EM a risoluzione molto più elevata disponibili oggi sulla destra. Queste immagini ad alta risoluzione consentono ai ricercatori di costruire modelli molecolari di proteine difficili da studiare (estrema destra). Credito:Martin Högbom/The Royal Swedish Academy of Science
"Non si tratta solo di vedere le proteine un po' più chiaramente, "Spiega Agard. "C'è un punto preciso in cui si passa dal vedere delle chiazze piuttosto inutili al saper interpretare direttamente la struttura di una molecola. Le fotocamere per il conteggio degli elettroni hanno davvero fornito un salto di qualità nella nostra capacità di comprendere la chimica sottostante di una proteina, sia come funziona sia come è possibile progettare farmaci che si legano ad essa".
Dal loro primo articolo di successo nel 2013 che dimostrava che le nuove fotocamere e il software potevano risolvere le proteine con una risoluzione quasi atomica, la tecnologia ha visto un'ampia adozione da parte del settore. Ha anche reso possibili grandi progressi nella ricerca di Cheng e Agard, dalla comprensione delle proteine chiave alla sensazione di dolore, che potrebbe essere preso di mira da una nuova generazione di farmaci, alle scoperte su come le proteine mantengono la loro forma corretta, che ha importanti implicazioni per il cancro e malattie come il morbo di Alzheimer che sono caratterizzate da proteine deformi.
Un altro importante ricercatore di crio-EM presso l'UCSF, Adam Frost, dottore, dottorato di ricerca, che è entrato a far parte dell'università come assistente universitario nel 2014 per sfruttare la potenza di questa nuova tecnologia, ha guidato gli sforzi per utilizzare la crio-EM per determinare come nuove classi di farmaci si legano alle loro proteine bersaglio a livello atomico.
"Cryo-EM ci consente ora di studiare le proteine a un livello di dettaglio che non sarebbe mai stato possibile solo pochi anni fa, " disse Gelo.
Frost and Cheng have also been using cryo-EM to understand how signaling proteins on the surfaces of cells – key targets for pharmaceuticals from pain killers to cancer therapies – are influenced by the cell membranes in which they float and how proteins can bend and shape the membranes. In particolare, the ability to examine the structure of proteins in their native membranes – which had also been considered impossible by the field – was achieved for the first time in 2016 by Cheng.
The recent work with cryo-EM has been so successful that many researchers at UCSF have begun clamoring for a share of the limited microscopy time available on shared scopes. Fortunatamente, with the acquisition earlier this year of new fully automated cryo-electron microscopes, including a $5 million state-of-the-art Titan Krios system funded by the Howard Hughes Medical Institute, a $6 million Titan Krios funded by an anonymous donor for the UCSF Institute of Neurodegenerative Disease – part of the UCSF Weill Institute for Neurosciences – and a $3 million Arctica system funded by the National Institutes of Health and UCSF, more and more researchers across the University and the Bay Area will be able to take their research to the next level.
Agard sees the cryo-EM revolution as closely synergistic to other burgeoning efforts on campus to completely map out the biology of disease, such as the work of Nevan Krogan, dottorato di ricerca, the director of UCSF's Quantitative Biosciences Institute, who is mapping the common networks of genes and proteins that drive diseases ranging from cancer to HIV to schizophrenia; and the work of Brian Shoichet, dottorato di ricerca, whose lab in UCSF's School of Pharmacy uses protein structures to computationally design custom drugs that fit like lock and key into target proteins.
"There is a remarkably integrated pipeline being developed at UCSF, with new technologies and approaches feeding off one another to advance our knowledge of the biology of disease at every level, " Agard said. "This is beginning to have a huge impact all around campus, but now we need to scale it up to lower barriers and speed the transition from images to therapies."