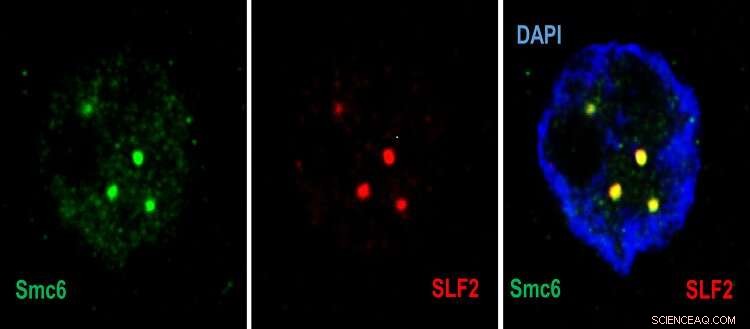
Immagini al microscopio confocale che mostrano nel nucleo cellulare (blu), il reclutamento di Smc5/6 (verde) da parte di SLF2 (rosso) nei corpi PML. Credito:© UNIGE–Laboratorio del Professor Michel Strubin–Regolazione dell'espressione genica del virus dell'epatite B–Dipartimento di Microbiologia e Medicina Molecolare.
Il virus dell'epatite B (HBV) è responsabile di una delle malattie infettive più gravi e comuni. Trasmesso attraverso fluidi biologici, attacca le cellule del fegato. La forma cronica della malattia può portare a gravi complicazioni, tra cui cirrosi e cancro al fegato. Non esiste un trattamento efficace per la forma cronica della malattia, che può essere prevenuta solo con la vaccinazione. Dopo aver identificato un complesso proteico chiave che è attivo quando il nostro corpo viene infettato dal virus, un team dell'Università di Ginevra (UNIGE) ha decifrato il preciso funzionamento di questo meccanismo protettivo, aprendo la strada a nuovi bersagli terapeutici. Questi risultati possono essere letti sulla rivista Nature Structural &Molecular Biology .
L'epatite B è la forma più comune di epatite. È una malattia virale causata dal virus dell'epatite B. Viene principalmente trasmesso o trasferito sessualmente attraverso il sangue. È fino a 100 volte più contagioso dell'HIV. Infettando le cellule del fegato, questo virus provoca un'infiammazione transitoria di questo organo che può evolvere anche verso un'infezione cronica. Questo può quindi portare a gravi patologie, come la cirrosi o il cancro al fegato. Si stima che quasi 1 milione di persone muoiano ogni anno a causa di questa malattia in tutto il mondo. Non esiste un trattamento definitivo per l'epatite cronica B. L'unico modo per prevenirla è vaccinarsi prima che la malattia si manifesti.
Nel 2016 un team UNIGE guidato da Michel Strubin, professore associato presso il Dipartimento di Microbiologia e Medicina Molecolare e presso il Centro di ricerca sull'infiammazione di Ginevra presso la Facoltà di Medicina dell'UNIGE, ha rivelato un meccanismo fondamentale per la comprensione di questa malattia:quando il nostro il sistema immunitario si difende da esso, un complesso, un insieme interdipendente, di sei proteine chiamate SMC5/6, presenti nelle nostre cellule, rileva il DNA virale e lo blocca. Il virus quindi reagisce e produce una proteina specifica, la proteina X. Questa proteina entra nella cellula e degrada SMC5/6, che non è più in grado di svolgere il suo ruolo di sentinella.
Un meccanismo in tre fasi
Prima di questa scoperta, la funzione antivirale di SMC5/6 era sconosciuta. È stato identificato solo come un complesso chiave per il mantenimento strutturale dei nostri cromosomi. Oggi, la squadra di Michel Strubin ha fatto una nuova svolta. In un recente studio, condotto in collaborazione con l'azienda farmaceutica americana Gilead Sciences, i ricercatori UNIGE hanno identificato i tre passaggi e le proteine specifiche necessarie affinché SMC5/6 svolga il suo ruolo antivirale.
"Nella prima fase, una proteina del complesso SMC5/6 rileva il DNA del virus e lo intrappola", spiega Fabien Abdul, ricercatore senior e assistente didattico presso il Dipartimento di Microbiologia e Medicina Molecolare della Facoltà di Medicina dell'UNIGE e primo autore dello studio. "Quindi, una seconda proteina del complesso, SLF2, porta il DNA intrappolato del virus in un sottocompartimento del nucleo della cellula attaccata, chiamato corpo PML. Una terza proteina, Nse2, entra quindi in gioco e inibisce il cromosoma del virus."
Poiché l'SMC è una grande famiglia di complessi proteici, i ricercatori volevano anche sapere se altri membri di questa famiglia fossero in grado di legarsi al DNA virale dell'epatite B. "Abbiamo scoperto che questa competenza era esclusiva di SMC5/6", afferma Fabien Abdul.
Verso nuovi bersagli terapeutici
Per ottenere questi risultati, il team di ricerca ha lavorato su colture cellulari in vitro. "Abbiamo utilizzato tecniche di biologia molecolare e più specificamente le forbici genetiche chiamate CRISPR-Cas9. Questo strumento ci ha permesso di tagliare i filamenti di DNA all'interno delle cellule e quindi eliminare o modificare il gene codificante per ciascuna proteina che costituisce il complesso SMC5/6. Grazie a questa tecnica , siamo stati in grado di far scomparire l'una o l'altra delle proteine e quindi di comprendere le rispettive funzioni all'interno del complesso", spiega Michel Strubin, l'ultimo autore dello studio. Sulla base di queste osservazioni, si potrebbero stabilire le tre fasi del meccanismo antivirale.
Questa scoperta fornisce una migliore comprensione di come funziona il complesso durante la sua azione antivirale. Potrebbe così aprire la strada all'identificazione di nuovi bersagli terapeutici per combattere il virus dell'epatite B. "La prossima fase della ricerca consisterà nel decifrare meglio il meccanismo di inibizione del virus nel sottocompartimento del nucleo cellulare", indica Aurélie Diman, ricercatrice post-dottorato nel laboratorio di Michel Strubin. Dovrà essere svolto un lavoro anche sulla proteina X, il cui ruolo è stato identificato dai ricercatori UNIGE nel 2016, al fine di comprendere meglio il meccanismo di contrattacco dell'epatite B contro l'attività antivirale della SMC5/6 cellulare. + Esplora ulteriormente