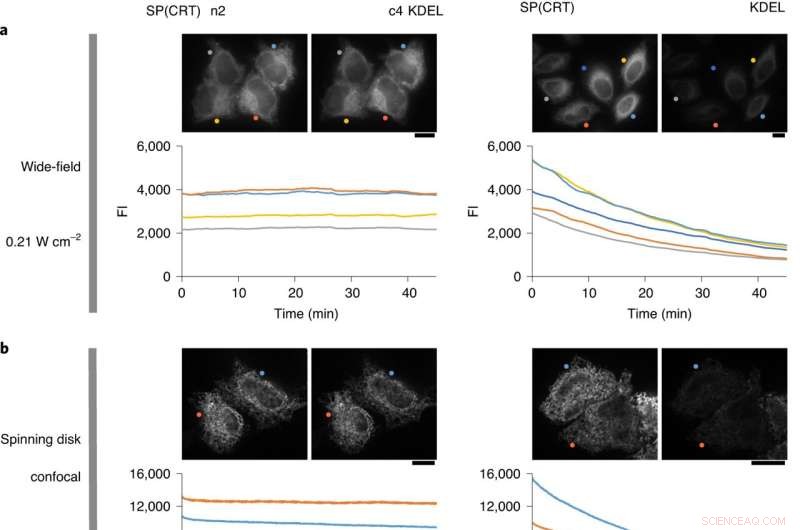
Fotostabilità di un mutante di cisteina di StayGold mirato al lume ER. Le cellule HeLa che esprimono er-(n2)oxStayGold(c4) o er-oxGFP sono state sottoposte a imaging dal vivo continuo. Il confronto è stato fatto fianco a fianco. Barre di scala, 10 μm. a, illuminazione WF (lampada ad arco) con un valore di irraggiamento di 0,21 W cm −2 . b, Illuminazione confocale del disco rotante con un valore di irraggiamento di 3,5 W cm −2 . a,b, Vengono visualizzate la prima e l'ultima immagine (in alto). Le intensità medie di fluorescenza delle singole cellule sono tracciate rispetto al tempo (in basso). c, Imaging 3D-SIM volumetrico con un valore di irradianza di 2,4 W cm −2 . Raccolta ripetitiva di uno stack 3D di 56 immagini 3D-SIM. Immagini 3D-SIM grezze e ricostruite del 51° (sinistra) o 48° (destra) piano nelle serie z 1 e 2. Vengono tracciate le intensità medie di fluorescenza delle singole cellule (in basso). Credito:Biotecnologie naturali (2022). DOI:10.1038/s41587-022-01278-2
L'imaging a fluorescenza di campioni biologici trarrà grandi benefici dalla scoperta di RIKEN di una proteina fluorescente derivata da una medusa giapponese che mantiene la sua luminosità anche se illuminata da una luce forte.
Le proteine che emettono luce verde quando illuminate sono potenti strumenti per l'imaging di strutture fini all'interno delle cellule viventi. I ricercatori possono attaccare tali proteine fluorescenti alle strutture bersaglio a cui sono interessati, che poi si accendono quando viene illuminata dalla luce blu.
Tuttavia, i ricercatori si trovano in una situazione di stallo:vogliono utilizzare la minor quantità possibile di proteine fluorescenti in modo che non interferisca con i normali processi cellulari, ma ciò richiede l'uso di una forte illuminazione per ottenere immagini di alta qualità. Il problema è che quando una forte luce viene proiettata su una proteina fluorescente, la sua luminosità diminuisce rapidamente a causa di un processo noto come fotosbiancamento. A complicare le cose, c'è una relazione di compromesso tra luminosità e fotostabilità:aumentandone una si ridurrà quasi inevitabilmente l'altra.
Ora, Atsushi Miyawaki del RIKEN Center for Brain Science e i suoi colleghi hanno scoperto una proteina fluorescente che non rispetta questa relazione di compromesso:offre sia un'elevata luminosità mentre è circa dieci volte più fotostabile delle migliori proteine fluorescenti commerciali.
Denominata in modo appropriato StayGold, la proteina fluorescente è derivata da una proteina fluorescente presente in natura che si trova in Cytaeis uchidae, una minuscola medusa che si trova al largo delle coste del Giappone.
C'era un elemento di serendipità nella scoperta. "We noticed that the fluorescent protein from the jellyfish was photostable but very dim. And I wasn't optimistic about making the protein brighter while keeping that photostability, because I simply believed the tradeoff," recalls Miyawaki. "However, to our surprise, we were able to increase both the protein's photostability and its brightness. So could have our cake and eat it too."
The team demonstrated the usefulness of StayGold by using it to image the endoplasmic reticulum network and mitochondria in cells with enhanced spatiotemporal resolution and length of observation. They also used it to image the spike protein of SARS-CoV-2, the virus that causes COVID-19, in infected cells.
The intense interest generated by the study is reflected in the fact that it has been accessed more than 44,000 times since publication in Nature Biotechnology in late April. Researchers wanting to try the protein can obtain it from the RIKEN BioResource Research Center.
Since it remains unclear why StayGold can both be bright and stay bright under illumination, Miyawaki and his team intend to investigate the mechanism behind this. + Esplora ulteriormente