I batteri Neisseria gonorrhoeae potrebbero aver guidato l'evoluzione delle varianti genetiche umane che proteggono dalla demenza. Credito:National Institute of Allergy and Infectious Diseases, National Institutes of Health
I ricercatori della San Diego School of Medicine dell'Università della California hanno precedentemente scoperto una serie di mutazioni genetiche umane che proteggono gli anziani dal declino cognitivo e dalla demenza. In un nuovo studio, pubblicato il 9 luglio 2022 in Biologia molecolare ed evoluzione , si concentrano su uno di questi geni mutati e tentano di tracciarne l'evoluzione, quando e perché è apparso nel genoma umano. I risultati suggeriscono che la pressione selettiva da agenti patogeni infettivi come la gonorrea potrebbe aver promosso l'emergere di questa variante genetica nell'Homo sapiens e inavvertitamente sostenuto l'esistenza dei nonni nella società umana.
La biologia della maggior parte delle specie animali è ottimizzata per la riproduzione, spesso a scapito della salute futura e di una maggiore durata della vita. In effetti, gli esseri umani sono una delle uniche specie conosciute a vivere ben oltre la menopausa. Secondo l '"ipotesi della nonna", ciò è dovuto al fatto che le donne anziane forniscono un supporto importante nell'allevare neonati e bambini umani, che richiedono più cure rispetto ai piccoli di altre specie. Gli scienziati stanno ora cercando di capire quali caratteristiche della biologia umana rendono possibile questa salute a lungo termine.
Quando i ricercatori hanno precedentemente confrontato i genomi umani e di scimpanzé, hanno scoperto che gli esseri umani hanno una versione unica del gene per CD33, un recettore espresso nelle cellule immunitarie. Il recettore CD33 standard si lega a un tipo di zucchero chiamato acido sialico di cui sono rivestite tutte le cellule umane. Quando la cellula immunitaria percepisce l'acido sialico tramite CD33, riconosce l'altra cellula come parte del corpo e non la attacca, prevenendo una risposta autoimmune.
Il recettore CD33 è anche espresso nelle cellule immunitarie cerebrali chiamate microglia, dove aiuta a controllare la neuroinfiammazione. Tuttavia, la microglia ha anche un ruolo importante nell'eliminare le cellule cerebrali danneggiate e le placche amiloidi associate al morbo di Alzheimer. Legandosi agli acidi sialici su queste cellule e placche, i normali recettori CD33 sopprimono effettivamente questa importante funzione microgliale e aumentano il rischio di demenza.
È qui che entra in gioco la nuova variante genetica. Da qualche parte lungo la linea evolutiva, gli esseri umani hanno raccolto un'ulteriore forma mutata di CD33 a cui manca il sito di legame dello zucchero. Il recettore mutato non reagisce più agli acidi sialici sulle cellule e sulle placche danneggiate, consentendo alla microglia di scomporle. In effetti, livelli più elevati di questa variante CD33 sono risultati indipendentemente protettivi contro l'Alzheimer a esordio tardivo.
Nel tentativo di capire quando è emersa per la prima volta questa variante genetica, il co-autore senior Ajit Varki, MD, Distinguished Professor of Medicine and Cellular and Molecular Medicine presso la UC San Diego School of Medicine, e colleghi hanno trovato prove di una forte selezione positiva, suggerendo che qualcosa stava guidando il gene ad evolversi più rapidamente del previsto. Hanno anche scoperto che questa particolare versione di CD33 non era presente nei genomi dei Neanderthal o dei Denisoviani, i nostri parenti evolutivi più stretti.
"Per la maggior parte dei geni che sono diversi negli umani e negli scimpanzé, i Neanderthal di solito hanno la stessa versione degli umani, quindi questo è stato davvero sorprendente per noi", ha detto Varki. "Questi risultati suggeriscono che la saggezza e la cura di nonni sani potrebbero essere stati un importante vantaggio evolutivo che avevamo rispetto ad altre antiche specie di ominidi".
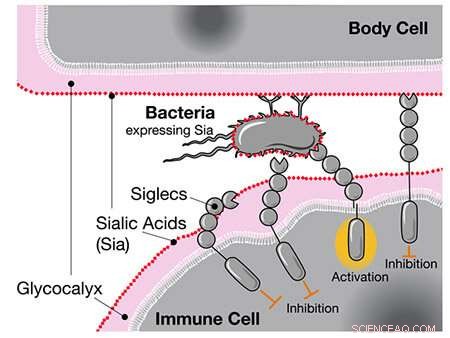
Quando Siglec come il CD33 rilevano gli acidi sialici umani, inibiscono la risposta delle cellule immunitarie, anche se quegli acidi si trovano sui batteri. Credito:UC San Diego Health Sciences
Varki ha condotto lo studio con Pascal Gagneux, Ph.D., professore di patologia presso la UC San Diego School of Medicine e professore presso il Dipartimento di Antropologia. Gli autori hanno affermato che lo studio fornisce nuove prove a sostegno dell'ipotesi della nonna.
Tuttavia, la teoria evolutiva afferma che il successo riproduttivo è il principale motore della selezione genetica, non della salute cognitiva post-riproduttiva. Quindi cosa stava spingendo la prevalenza di questa forma mutata di CD33 negli esseri umani?
Una possibilità, suggeriscono gli autori, è che malattie altamente infettive come la gonorrea, che possono essere dannose per la salute riproduttiva, potrebbero aver avuto un impatto sull'evoluzione umana. I batteri della gonorrea si ricoprono degli stessi zuccheri a cui si legano i recettori CD33. Come un lupo travestito da pecora, i batteri sono in grado di ingannare le cellule immunitarie umane per non identificarle come invasori esterni.
I ricercatori suggeriscono che la versione mutata di CD33 senza un sito di legame dello zucchero è emersa come un adattamento umano contro tale "mimetismo molecolare" da parte della gonorrea e di altri agenti patogeni. Infatti, hanno confermato che una delle mutazioni specifiche per l'uomo è stata in grado di abolire completamente l'interazione tra i batteri e il CD33, il che consentirebbe alle cellule immunitarie di attaccare nuovamente i batteri.
Complessivamente, gli autori ritengono che gli esseri umani abbiano inizialmente ereditato la forma mutata di CD33 per proteggersi dalla gonorrea durante l'età riproduttiva e che questa variante del gene sia stata successivamente cooptata dal cervello per i suoi benefici contro la demenza.
"È possibile che CD33 sia uno dei tanti geni selezionati per i loro vantaggi in termini di sopravvivenza contro agenti patogeni infettivi nella prima infanzia, ma che siano poi selezionati secondariamente per i loro effetti protettivi contro la demenza e altre malattie legate all'invecchiamento", ha affermato Gagneux.
I coautori includono Sudeshna Saha, Naazneen Khan, Andrea Verhagen, Aniruddha Sasmal e Sandra Diaz all'UC San Diego; Troy Comi e Joshua M. Akey all'Università di Princeton; Hai Yu e Xi Chen alla UC Davis e Martin Frank alla Biognos AB.