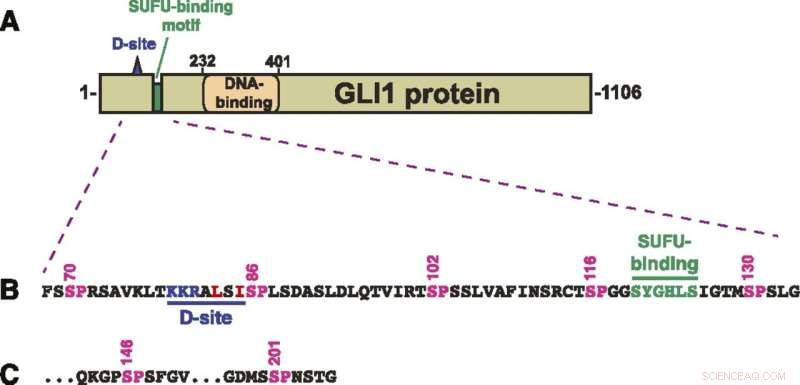
Struttura della proteina GLI1. (A) Schema della struttura primaria della proteina GLI1 umana, che mostra il sito di aggancio MAPK (sito D), il motivo di legame SUFU e il dominio di legame del DNA del dito di zinco. Il dominio di attivazione trascrizionale costituisce una grande frazione della metà C-terminale della proteina. (B) Sequenza di amminoacidi di residui 68–134, che mostra il sito D, il motivo di legame SUFU e un gruppo di cinque siti di fosforilazione MAPK canonici (SP). I numeri sopra mostrano la posizione dei residui di serina nei siti SP. (C) Gli ultimi due dei sette siti di fosforilazione SP MAPK contenuti nei residui di 68-232 GLI1. Dopo S201, il successivo sito SP o TP si trova in S441. Credito:A. Jane Bardwell et al, Life Science Alliance (2022). DOI:10.26508/lsa.202101353
Trattamenti migliori per alcune delle forme più letali del cancro potrebbero essere più vicini grazie a una scoperta guidata da Irvine dell'Università della California su come una determinata proteina viene attivata nelle cellule tumorali. La scoperta, guidata dai ricercatori della School of Biological Sciences, potrebbe portare a possibili terapie per il melanoma particolarmente pericoloso e l'adenocarcinoma del pancreas, nonché per il tipo più comune di cancro al cervello infantile e cancro della pelle degli adulti. Un documento che descrive il progetto appare in Life Science Alliance .
La scoperta riguarda la proteina GLI1, che è importante nello sviluppo cellulare ma è stata trovata attiva anche in vari tumori. GLI1 è tipicamente attivato dalla via di segnalazione Hedgehog, nota come HH. Tuttavia, gli scienziati sanno da circa un decennio che il crosstalk (interazione) tra HH e la via della proteina chinasi attivata dal mitogeno ha un ruolo nei tumori.
"In alcuni casi, le proteine in un percorso possono attivare proteine in un altro", ha affermato l'autrice principale A. Jane Bardwell, scienziata del progetto presso il Dipartimento di biologia cellulare e dello sviluppo dell'UCI. "È un sistema complesso. Volevamo comprendere il meccanismo molecolare che porta GLI1 ad essere attivato dalle proteine nel percorso MAPK."
GLI1 normalmente si lega strettamente con una proteina chiamata SUFU. Quella proteina sopprime GLI1, impedendogli di penetrare nei nuclei cellulari e di attivare i geni. Gli scienziati hanno esaminato sette siti sulla proteina GLI1 che potrebbero essere fosforilati o trasferire su di essa un gruppo fosfato.
"Ne abbiamo identificati tre che possono essere fosforilati e sono coinvolti nell'indebolimento del legame tra GLI1 e SUFU", ha affermato Lee Bardwell, professore di biologia cellulare e dello sviluppo, il cui laboratorio ha condotto il progetto. "Questo processo attiva GLI1, consentendogli di entrare nel nucleo delle cellule, dove può causare una crescita incontrollata con conseguente cancro."
Ha notato che la fosforilazione di tutti e tre i siti provoca un livello significativamente più alto di fuga di GLI1 da SUFU rispetto a se solo uno o anche due di essi ricevessero gruppi fosfato.
La scoperta è un passo significativo verso trattamenti contro il cancro più efficaci e personalizzati. "Se riusciamo a capire esattamente cosa sta succedendo in un determinato cancro o in un particolare tumore, potrebbe essere possibile sviluppare un farmaco specifico per un tumore specifico o per un singolo paziente", ha detto Bardwell. "Ci permetterebbe di curare queste malattie senza la tossicità della chemioterapia di base". Inoltre, molti tumori dello stesso tumore hanno mutazioni diverse tra gli individui. Alla fine, potrebbe essere possibile eseguire lo screening dei tumori per sviluppare l'approccio migliore per ciascuno.
La ricerca è stata condotta in collaborazione con il Dipartimento di Microbiologia e Genetica Molecolare dell'UCI School of Medicine e il Dipartimento di Dermatologia della Stanford University School of Medicine.