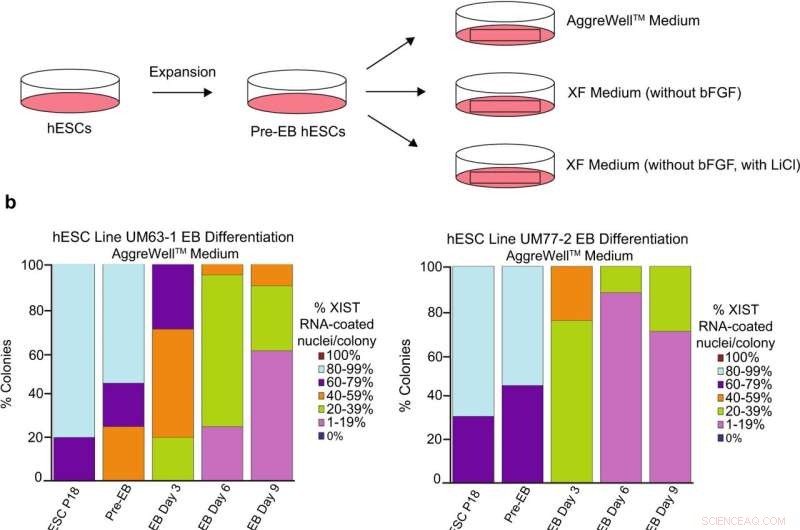
Analisi del rivestimento di XIST RNA durante la differenziazione delle hESC femminili. uno schema di differenziazione di hESC in corpi embrionali (EB) con tre diverse formulazioni di media:un AggreWell TM disponibile in commercio medio; XF medio privo di bFGF; e mezzo XF privo di bFGF ma contenente LiCl 0,98 mM. b Percentuale di nuclei con rivestimento di RNA XIST negli EB generati dalle linee hESC UM77-2 e UM63-1. EB generati e coltivati in terreno XF con LiCl e AggreWell TM il terreno ha perso una percentuale significativa del rivestimento di XIST RNA per colonia rispetto agli EB generati e coltivati in terreno XF (confronto del modello lineare generale; p < 0,001). Almeno 100 nuclei sono stati contati per colonia per la quantificazione di hESC RNA FISH. Il numero totale di colonie quantificate ad ogni passaggio è compreso tra 10 e 17 e sono catalogate nei dati di origine. I dati di origine vengono forniti come file di dati di origine. Credito:Comunicazioni sulla natura (2022). DOI:10.1038/s41467-022-30259-x
Nella maggior parte dei mammiferi, le femmine hanno due cromosomi X e i maschi hanno un cromosoma X e un cromosoma Y in ciascuna delle loro cellule. Per evitare una doppia dose di geni legati all'X nelle femmine, una delle X viene silenziata all'inizio del processo di sviluppo. Questo silenzio è fondamentale, ma il modo in cui avvenga è stato relativamente misterioso. Due nuovi studi U-M rivelano di più su questo processo di silenziamento e approfondimenti che potrebbero migliorare la ricerca sulle cellule staminali.
Le cellule staminali embrionali umane (hESC) sono molto promettenti per la ricerca sullo sviluppo precoce e per la medicina rigenerativa per malattie che vanno dal diabete di tipo 1 al morbo di Parkinson. Tuttavia, i biologi che lavorano con hESC femminili in laboratorio spesso si imbattono in un fenomeno in cui il cromosoma X normalmente inattivato perde questa soppressione mentre cresce in un piatto di coltura.
"Se non è possibile mantenere gli hESC esattamente come tali nella cultura, non è possibile utilizzarli per alcuna applicazione a valle", ha affermato Sundeep Kalantry, Ph.D., professore associato di genetica umana. Lui, insieme a Marissa Cloutier, un dottorato di ricerca. tirocinante e il loro team hanno deciso di determinare perché l'inattivazione dell'X si erode nel tempo in determinate condizioni sperimentali.
Il loro principale sospetto era la sostanza usata per far crescere le cellule in coltura, chiamata media. Le cellule vengono coltivate in mezzi che forniscono loro istruzioni chimiche chiamate fattori di crescita. Questi fattori di crescita segnalano alle cellule staminali di continuare a dividersi. Un mezzo popolare, chiamato mTeSR1, sembrava essere correlato alla perdita di un regolatore chiave dell'inattivazione dell'X, un filamento di RNA non codificante chiamato XIST. Un altro mezzo, chiamato Xenofree, non ha portato a una perdita di inattivazione dell'X.
"Abbiamo esaminato le differenze nella composizione di questi due mezzi e identificato il cloruro di litio come presente in mTeSR1 ma non in Xenofree", ha affermato Cloutier.
Il cloruro di litio è talvolta incluso nei media per promuovere la proliferazione delle cellule staminali, tuttavia è noto che interferisce con molte vie di segnalazione cellulare inibendo le proteine GSK-3. (Gli inibitori delle proteine GSK-3 sono stati usati per curare diverse malattie e il litio, usato per trattare il disturbo bipolare, è stato uno dei primi inibitori naturali del GSK-3 scoperto.)
Per confermare il cloruro di litio come colpevole, hanno aggiunto il composto al mezzo Xenofree e hanno visto una perdita di inattivazione dell'X. Il loro articolo è pubblicato su Nature Communications .
"In generale, in termini di comprensione dell'inattivazione di X, il nostro studio fornisce un possibile nuovo modello per la regolamentazione di questo processo", afferma Cloutier. Kalantry aggiunge che il loro studio suggerisce che i ricercatori devono essere un po' più cauti sull'uso degli inibitori del GSK-3 come il litio. "Potrebbero non solo interferire con l'inattivazione dell'X, ma anche con altre modalità di regolazione trascrizionale epigenetica nel genoma".
Ruolo di un antico gene legato all'X nell'induzione dell'inattivazione dell'X
Un documento separato, pubblicato anche in Nature Communications di Kalantry e colleghi, fornisce approfondimenti sull'evoluzione dell'inattivazione dell'X nei mammiferi. La premessa dello studio era che l'inattivazione dell'X è innescata da uno o più di un sottoinsieme di geni legati all'X che paradossalmente sfuggono all'inattivazione dell'X una volta iniziata l'inattivazione dell'X. Questi geni sono espressi da entrambi i cromosomi X nelle femmine rispetto a una singola X nei maschi e, di conseguenza, sono più espressi nelle femmine rispetto ai maschi. Il laboratorio di Kalantry in stretta collaborazione con il laboratorio di Shigeki Iwase, anch'esso presso l'Università del Michigan, ha scoperto che a causa della maggiore espressione nelle femmine rispetto ai maschi di uno di questi geni legati all'X, Kdm5c, induce Xist e quindi X-inattivazione selettivamente nelle femmine .
L'eliminazione di Kdm5c su entrambi i cromosomi X in una cellula femminile ha disattivato quasi completamente l'inattivazione dell'X. Al contrario, quando i ricercatori hanno introdotto Kdm5c nelle cellule di topo maschio, hanno avviato con successo l'inattivazione dell'X, che in circostanze normali non si sarebbe verificata.
Kdm5c è un gene ancestrale legato all'X condiviso da tutte le specie di mammiferi. Gli autori hanno testato e scoperto che Kdm5c da lignaggi di mammiferi marsupiali e monotremi evolutivamente distanti (ad esempio, l'ornitorinco che depone le uova), che si sono separati dai mammiferi placentari più di 150 milioni di anni fa, potrebbe anche indurre Xist e X-inattivazione nelle cellule di topo maschio . Questa scoperta suggerisce che Kdm5c ha mantenuto una funzione ancestrale per indurre Xist e X-inattivazione nei topi e nell'uomo.
"Se esprimono geni legati all'X a livelli superiori al normale in una cellula femminile, quella cellula spesso soffrirà e morirà. Nei maschi, se si riduce l'espressione dei geni legati all'X oltre i livelli normali inattivando quella singola X, il anche le cellule soffrono e muoiono", ha detto Kalantry. "Il livello corretto dei geni del cromosoma X è davvero molto importante per la salute della cellula."
Il team spera poi di spiegare il processo casuale che determina quale X in una cellula femminile viene silenziata:quella della madre o quella del padre. La determinazione di questo meccanismo di base, afferma Kalantry, potrebbe in futuro essere applicata per riattivare a piacimento i geni legati all'X per potenziali scopi terapeutici.