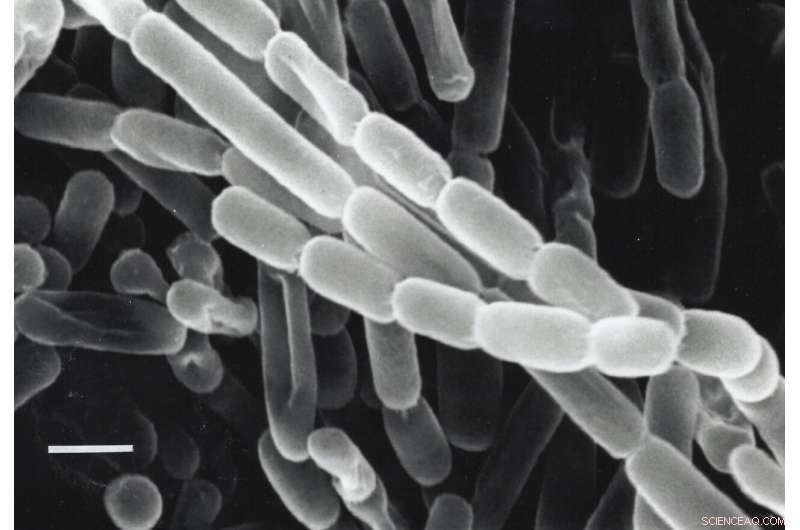
Uno sguardo ravvicinato a Kitasatospora setae, un batterio isolato dal suolo in Giappone. Questi batteri fissano il carbonio, trasformano l'anidride carbonica dal loro ambiente in biomolecole di cui hanno bisogno per sopravvivere, grazie a enzimi chiamati ECR. I ricercatori sono alla ricerca di modi per sfruttare e migliorare gli ECR per la fotosintesi artificiale per produrre combustibili, antibiotici e altri prodotti. Credito:Y. Takahashi e Y. Iwai
Le piante si affidano a un processo chiamato fissazione del carbonio, che trasforma l'anidride carbonica dall'aria in biomolecole ricche di carbonio, per la loro stessa esistenza. Questo è il punto centrale della fotosintesi e una pietra angolare del vasto sistema ad incastro che fa circolare il carbonio attraverso piante, animali, microbi e l'atmosfera per sostenere la vita sulla Terra.
Ma i campioni di fissazione del carbonio non sono le piante, ma i batteri del suolo. Alcuni enzimi batterici svolgono un passaggio chiave nella fissazione del carbonio 20 volte più velocemente degli enzimi vegetali e capire come lo fanno potrebbe aiutare gli scienziati a sviluppare forme di fotosintesi artificiale per convertire i gas serra in combustibili, fertilizzanti, antibiotici e altri prodotti.
Ora un team di ricercatori dello SLAC National Accelerator Laboratory del Dipartimento dell'Energia, dell'Università di Stanford, del Max Planck Institute for Terrestrial Microbiology in Germania, del Joint Genome Institute (JGI) del DOE e dell'Università di Concepción in Cile ha scoperto come un enzima batterico, un macchina che facilita le reazioni chimiche:accelera per eseguire questa impresa.
Invece di afferrare le molecole di anidride carbonica e attaccarle alle biomolecole una alla volta, hanno scoperto che questo enzima è costituito da coppie di molecole che lavorano in sincronia, come le mani di un giocoliere che lancia e prende simultaneamente le palle, per portare a termine il lavoro più velocemente . Un membro di ciascuna coppia di enzimi si apre completamente per catturare una serie di ingredienti di reazione mentre l'altro si chiude sui suoi ingredienti catturati ed esegue la reazione di fissazione del carbonio; quindi, cambiano ruolo in un ciclo continuo.
Un singolo punto di "colla" molecolare tiene insieme ogni paio di mani enzimatiche in modo che possano alternare apertura e chiusura in modo coordinato, ha scoperto il team, mentre un movimento di torsione aiuta a spingere ingredienti e prodotti finiti dentro e fuori dalle tasche dove le reazioni avere luogo. Quando sono presenti sia la colla che la torsione, la reazione di fissazione del carbonio è 100 volte più veloce che senza di esse.
"Questo enzima batterico è il fissatore di carbonio più efficiente che conosciamo e abbiamo fornito una chiara spiegazione di ciò che può fare", ha affermato Soichi Wakatsuki, professore allo SLAC e Stanford e uno dei leader senior dello studio. che è stato pubblicato su ACS Central Science questa settimana.
"Alcuni degli enzimi in questa famiglia agiscono lentamente ma in un modo molto specifico per produrre un solo prodotto", ha detto. "Altri sono molto più veloci e possono creare blocchi chimici per tutti i tipi di prodotti. Ora che conosciamo il meccanismo, possiamo progettare enzimi che combinano le migliori caratteristiche di entrambi gli approcci e svolgono un lavoro molto veloce con tutti i tipi di materiali di partenza".
Migliorare la natura
L'enzima studiato dal team fa parte di una famiglia chiamata enoil-CoA carbossilasi/riduttasi o ECR. Proviene dai batteri del suolo chiamati Kitasatospora setae, che oltre alle loro capacità di fissazione del carbonio possono anche produrre antibiotici.
Wakatsuki ha sentito parlare di questa famiglia di enzimi una mezza dozzina di anni fa da Tobias Erb del Max Planck Institute for Terrestrial Microbiology in Germania e Yasuo Yoshikuni del JGI. Il team di ricerca di Erb ha lavorato allo sviluppo di bioreattori per la fotosintesi artificiale per convertire l'anidride carbonica (CO2 ) dall'atmosfera a tutti i tipi di prodotti.
Per quanto importante sia la fotosintesi per la vita sulla Terra, ha detto Erb, non è molto efficiente. Come tutte le cose modellate dall'evoluzione nel corso degli eoni, è solo buono come deve essere, il risultato di basarsi lentamente sugli sviluppi precedenti ma senza mai inventare qualcosa di completamente nuovo da zero.
Inoltre, ha detto, il passaggio nella fotosintesi naturale che fissa la CO2 dall'aria, che si basa su un enzima chiamato Rubisco, è un collo di bottiglia che impantana l'intera catena di reazioni fotosintetiche. Pertanto, l'utilizzo di enzimi ECR veloci per eseguire questo passaggio e la loro progettazione per andare ancora più veloci, potrebbe portare un grande aumento dell'efficienza.
"Non stiamo cercando di fare una copia carbone della fotosintesi", ha spiegato Erb. "Vogliamo progettare un processo molto più efficiente utilizzando la nostra comprensione dell'ingegneria per ricostruire i concetti della natura. Questa 'fotosintesi 2.0' potrebbe aver luogo in sistemi viventi o sintetici come i cloroplasti artificiali, goccioline d'acqua sospese nell'olio".
Ritratti di un enzima
Wakatsuki e il suo gruppo stavano studiando un sistema correlato, la fissazione dell'azoto, che converte il gas di azoto dall'atmosfera in composti di cui gli esseri viventi hanno bisogno. Incuriosito dalla domanda sul perché gli enzimi ECR fossero così veloci, iniziò a collaborare con il gruppo di Erb per trovare risposte.
Hasan DeMirci, un ricercatore associato nel gruppo di Wakatsuki che ora è assistente professore alla Koc University e ricercatore presso lo Stanford PULSE Institute, ha guidato lo sforzo allo SLAC con l'aiuto di una mezza dozzina di stagisti estivi SLAC che ha supervisionato. "Ne addestriamo sei o sette ogni anno ed erano senza paura", ha detto. "Sono venuti con una mente aperta, pronti a imparare, e hanno fatto cose incredibili."
Il team SLAC ha preparato campioni dell'enzima ECR e li ha cristallizzati per l'esame con i raggi X presso l'Advanced Photon Source presso l'Argonne National Laboratory del DOE. I raggi X hanno rivelato la struttura molecolare dell'enzima, la disposizione della sua impalcatura atomica, sia da solo che quando è collegato a una piccola molecola ausiliaria che ne facilita il lavoro.
Ulteriori studi sui raggi X presso la Stanford Synchrotron Radiation Lightsource (SSRL) dello SLAC hanno mostrato come la struttura dell'enzima si spostasse quando si attaccava a un substrato, una specie di banco di lavoro molecolare che assembla gli ingredienti per la reazione di fissaggio del carbonio e stimola la reazione.
Infine, un team di ricercatori della Linac Coherent Light Source (LCLS) di SLAC ha condotto studi più dettagliati sull'enzima e sul suo substrato presso il laser giapponese SACLA a elettroni liberi a raggi X. La scelta di un laser a raggi X è stata importante perché ha permesso loro di studiare il comportamento dell'enzima a temperatura ambiente, più vicino al suo ambiente naturale, quasi senza danni da radiazioni.
Nel frattempo, il gruppo di Erb in Germania e il gruppo del professor Esteban Vöhringer-Martinez dell'Università di Concepción in Cile hanno condotto studi biochimici dettagliati e ampie simulazioni dinamiche per dare un senso ai dati strutturali raccolti da Wakatsuki e dal suo team.

Questa rappresentazione dell'ECR, un enzima presente nei batteri del suolo, mostra ciascuna delle sue quattro molecole identiche in un colore diverso. Queste molecole lavorano insieme in coppia, blu con bianco e verde con arancione, per trasformare l'anidride carbonica dall'ambiente del microbo in biomolecole di cui ha bisogno per sopravvivere. Un nuovo studio mostra che una macchia di colla molecolare e un'oscillazione e una torsione tempestive consentono a queste coppie di sincronizzare i loro movimenti e fissare il carbonio 20 volte più velocemente di quanto non facciano gli enzimi vegetali durante la fotosintesi. Credito:H. DeMirci et al.
Le simulazioni hanno rivelato che l'apertura e la chiusura delle due parti dell'enzima non coinvolgono solo la colla molecolare, ma anche i movimenti di torsione attorno all'asse centrale di ciascuna coppia di enzimi, ha affermato Wakatsuki.
"Questa svolta è quasi come un rachet che può spingere fuori un prodotto finito o tirare un nuovo set di ingredienti nella tasca dove avviene la reazione", ha detto. Insieme, la torsione e la sincronizzazione delle coppie di enzimi consentono loro di fissare il carbonio 100 volte al secondo.
La famiglia di enzimi ECR comprende anche un ramo più versatile che può interagire con molti diversi tipi di biomolecole per produrre una varietà di prodotti. Ma poiché non sono tenuti insieme dalla colla molecolare, non possono coordinare i loro movimenti e quindi operare molto più lentamente.
"Se potessimo aumentare la velocità di quelle reazioni sofisticate per creare nuove biomolecole", ha detto Wakatsuki, "sarebbe un salto significativo nel campo".
Da scatti statici a filmati fluidi
Finora gli esperimenti hanno prodotto istantanee statiche dell'enzima, degli ingredienti di reazione e dei prodotti finali in varie configurazioni.
"Il nostro esperimento da sogno", ha detto Wakatsuki, "sarebbe quello di combinare tutti gli ingredienti mentre scorrono nel percorso del raggio laser a raggi X in modo da poter osservare la reazione che si svolge in tempo reale".
Il team ci ha effettivamente provato alla SACLA, ha detto, ma non ha funzionato. "Il CO2 le molecole sono davvero piccole e si muovono così velocemente che è difficile cogliere il momento in cui si attaccano al substrato", ha detto. "Inoltre il raggio laser a raggi X è così forte che non potremmo trattenere gli ingredienti a lungo abbastanza perché la reazione abbia luogo. Quando ci siamo impegnati a fondo per farlo, siamo riusciti a rompere i cristalli."
Un imminente aggiornamento ad alta energia a LCLS risolverà probabilmente questo problema, ha aggiunto, con impulsi che arrivano molto più frequentemente, un milione di volte al secondo, e possono essere regolati individualmente in base alla forza ideale per ciascun campione.
Wakatsuki ha affermato che il suo team continua a collaborare con il gruppo di Erb e sta lavorando con il gruppo di consegna del campione LCLS e con i ricercatori delle strutture di microscopia elettronica criogenica SLAC-Stanford (crio-EM) per trovare un modo per far funzionare questo approccio.