Il trasportatore vescicolare delle monoammine 2 (VMAT2) è l'unica proteina trasportatrice nel sistema nervoso centrale che media l'immagazzinamento dei neurotrasmettitori delle monoammine. Svolge un ruolo fondamentale nel mediare la trasmissione degli impulsi nervosi e la neuroprotezione.
Attualmente, i meccanismi attraverso i quali VMAT2 riconosce e trasporta diversi neurotrasmettitori monoaminici strutturalmente diversi e l'induttore della malattia di Parkinson MPP + non sono chiari e anche il meccanismo molecolare del trasporto del substrato accoppiato a protoni deve essere ulteriormente esplorato.
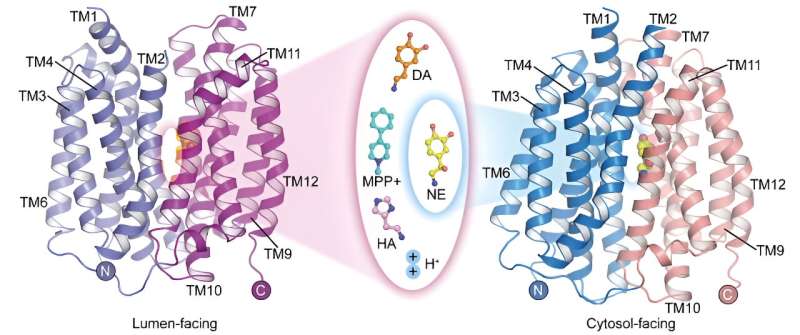
In uno studio pubblicato su Cell Research il 22 maggio, un gruppo di ricerca guidato dal Prof. Zhao Yan dell'Istituto di Biofisica dell'Accademia Cinese delle Scienze (CAS), in collaborazione con il Prof. Jiang Daohua dell'Istituto di Fisica del CAS, ha riportato la struttura apo dell'organismo umano trasportatore vescicolare della monoammina 2 (hVMAT2) a basso pH, le complesse strutture di vescicole rivolte verso dopamina, norepinefrina, istamina e la neurotossina MPP + legame e la struttura complessa del legame della norepinefrina nello stato rivolto verso il citosol.
Queste strutture rivelano le basi strutturali del riconoscimento del substrato VMAT2 e perfezionano ulteriormente il meccanismo molecolare del trasporto del substrato accoppiato a protoni.
Sebbene norepinefrina, dopamina, serotonina e MPP + hanno strutture molecolari diverse, le complesse strutture di legame di VMAT2 a questi substrati mostrano che tutti si legano a posizioni simili sulla proteina trasportatrice. Tuttavia, sottili differenze in alcuni gruppi funzionali di questi substrati portano a differenze significative e critiche nelle loro interazioni e modalità di legame con la proteina trasportatrice. Queste differenze illustrano come VMAT2 riconosca in modo efficiente diverse molecole di substrato.
I ricercatori hanno riportato le strutture del legame della norepinefrina al VMAT2 in diverse conformazioni, comprese le conformazioni rivolte al citosol e alle vescicole.
Nonostante i significativi cambiamenti conformazionali in VMAT2, la tasca di legame del substrato per la norepinefrina rimane relativamente stabile durante questo processo, senza cambiamenti significativi nelle interazioni con i residui circostanti. Questa intelligente transizione conformazionale è cruciale per il funzionamento di VMAT2.
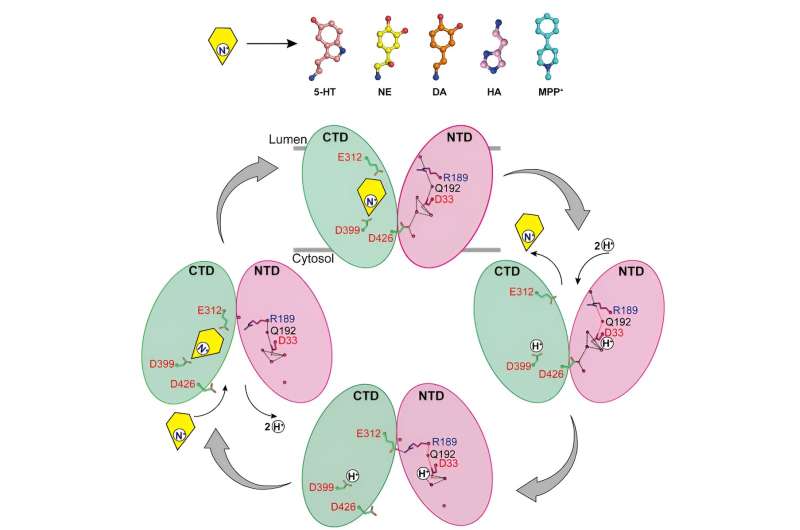
Analizzando le strutture di VMAT2 a diverse condizioni di pH, è stato confermato che D33 potrebbe essere un altro sito chiave di protonazione.
Analizzando in modo approfondito i meccanismi mediante i quali VMAT2 riconosce diversi neurotrasmettitori monoamminici e neurotossine strutturalmente diversi, questo lavoro propone un modello molecolare per i cambiamenti conformazionali di VMAT2 e perfeziona ulteriormente il meccanismo specifico del trasporto del substrato accoppiato a protoni.
Questi risultati forniscono preziose informazioni per una comprensione completa della modalità di trasporto VMAT2, arricchiscono il sistema di conoscenza del principale facilitatore del trasporto del substrato della superfamiglia e gettano una base importante per lo sviluppo e l'ottimizzazione dei farmaci.
Ulteriori informazioni: Di Wu et al, Istantanee strutturali del VMAT2 umano rivelano approfondimenti sul riconoscimento del substrato e sul meccanismo di accoppiamento dei protoni, Cell Research (2024). DOI:10.1038/s41422-024-00974-9
Informazioni sul giornale: Ricerca cellulare
Fornito dall'Accademia cinese delle scienze