La piroptosi è un tipo di morte cellulare programmata mediata dalla famiglia di proteine gasdermin (GSDM), che svolge un ruolo importante nella difesa dell'organismo contro le infezioni patogene, nell'eliminazione di cellule anormali o dannose e in altri processi. I GSDM sono una classe evolutivamente conservata di proteine che formano pori ampiamente distribuite tra vari batteri, funghi, invertebrati e tutti i vertebrati.
I GSDM hanno tipicamente una struttura a due domini autoinibiti. La scissione proteolitica sembra essere un meccanismo universale per l'attivazione di tutti i GSDM. Non è noto se esistano meccanismi di attivazione diversi dalla scissione della proteasi per i GSDM.
In uno studio pubblicato su Science , i ricercatori guidati dal Prof. Ding Jingjin dell'Istituto di biofisica dell'Accademia cinese delle scienze e dal Prof. Shao Feng dell'Istituto nazionale di scienze biologiche hanno rivelato nuovi meccanismi per l'attivazione indipendente dalla scissione di due tipi di proteine GSDM provenienti da eucarioti inferiori.
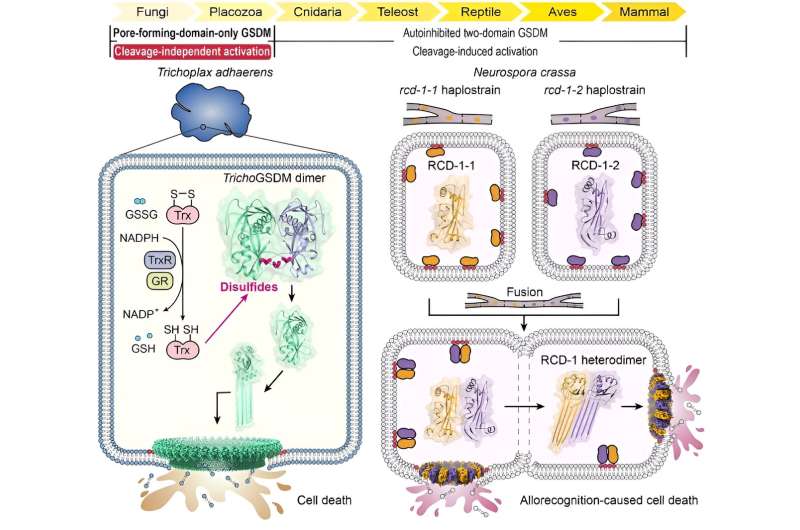
Attraverso un'analisi approfondita dell'omologia di sequenza, i ricercatori hanno innanzitutto identificato una proteina GSDM nel metazoo basale Trichoplax adhaerens (TrichoGSDM) che contiene solo un dominio che forma pori. La caratterizzazione di TrichoGSDM purificato ha rivelato che questa proteina GSDM esiste in due stati:monomero e omodimero, con solo la proteina monomerica che ha la capacità di formare pori sui liposomi.
Analisi strutturali e biochimiche hanno rivelato che l'omodimero legato al disolfuro rappresenta lo stato autoinibitorio di TrichoGSDM, che viene attivato allo stato monomerico riducendo i legami disolfuro, oligomerizzando ulteriormente e formando pori sulla membrana cellulare per indurre la morte cellulare simile alla piroptosi. Questo nuovo meccanismo di attivazione, scoperto in TrichoGSDM, è il primo del suo genere nell'intera famiglia GSDM.
Inoltre, i ricercatori si sono concentrati su un altro tipo di proteina GSDM che forma solo i pori, chiamata RCD-1, che è stata recentemente identificata nel fungo filamentoso Neurospora crassa. RCD-1 contiene due proteine omologhe, RCD-1-1 e RCD-1-2 in diversi ceppi, che governano la morte delle cellule fungine indotta dall'alloriconoscimento.
Hanno scoperto che le proteine RCD-1 legate alla membrana esistono in uno stato di riposo inattivo quando vengono lasciate sole. Tuttavia, quando ceppi diversi subiscono la fusione cellulare, le due proteine RCD-1 si incontrano e si assemblano in un eterodimero attraverso uno specifico riconoscimento intermolecolare, formando ulteriormente pori eterooligomerici sulla membrana cellulare per eseguire la morte cellulare simile alla piroptosi.
In questo studio, TrichoGSDM e RCD-1 rappresentano due tipi di GSDM costituiti solo da domini che formano pori derivati da eucarioti semplici e antichi che utilizzano meccanismi di attivazione indipendenti dalla scissione distinti.
TrichoGSDM è un dimero autoinibito legato al disolfuro e viene attivato dalla riduzione dei disolfuri, suggerendo una funzione responsiva al redox. L'attività di formazione dei pori in RCD-1 è stimolata dall'eteroriconoscimento tra RCD-1-1 e RCD-1-2 da ceppi fungini geneticamente incomparabili, alla base della morte cellulare indotta dall'alloriconoscimento in N. crassa.
I diversi meccanismi di attivazione suggeriscono che le proteine GSDM possono rispondere a un'ampia gamma di segnali fisiologici e partecipare a molteplici processi biologici. Inoltre, queste proteine GSDM che formano solo domini che formano pori hanno il potenziale per essere sviluppate come nuovi strumenti per indurre la morte cellulare indipendentemente dalla scissione della proteasi, facilitando la ricerca di base e traslazionale correlata alla piroptosi.
Ulteriori informazioni: Yueyue Li et al, Attivazione indipendente dalla scissione di antichi gasdermini eucariotici e meccanismi strutturali, Scienza (2024). DOI:10.1126/science.adm9190
Informazioni sul giornale: Scienza
Fornito dall'Accademia cinese delle scienze