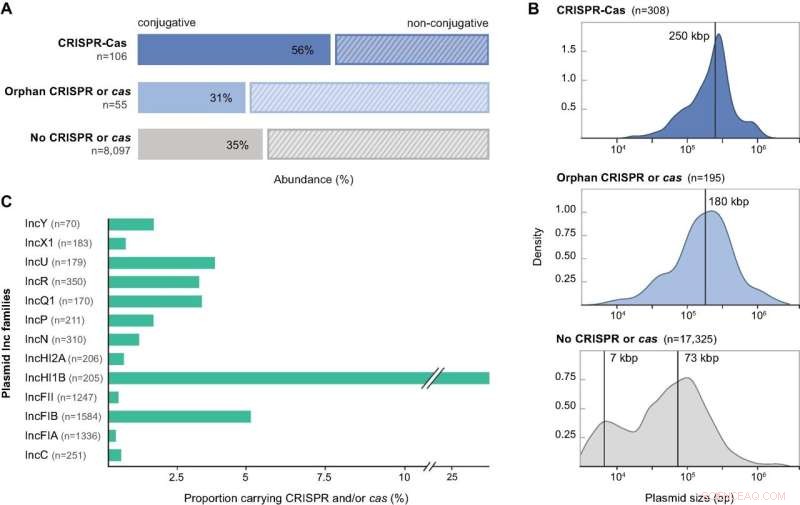
Caratteristiche dei plasmidi che codificano per i componenti CRISPR-Cas. (A) Previsioni di mobilità per la raccolta di plasmidi proteobatterici non ridondanti analizzati in questo studio, presentati in base ai loro contenuti CRISPR-Cas:loci CRISPR-Cas completi, CRISPR orfani o cas e nessun CRISPR o cas. (B) Distribuzioni dimensionali per la raccolta di genomi plasmidici che trasportano loci CRISPR-Cas completi, array orfani, operoni cas solitari e nessun gene CRISPR o cas. Le linee verticali indicano la dimensione mediana del plasmide per le distribuzioni unimodali e le medie stimate da un modello di miscela gaussiana a 2 componenti per la distribuzione bimodale. Le densità sono calcolate con i parametri predefiniti in base R. (C) Distribuzione dei gruppi di incompatibilità plasmidica all'interno della frazione tipizzabile Inc del set di dati plasmidico completo e abbondanza relativa del sottoinsieme codificante CRISPR-Cas loci. I singoli plasmidi possono appartenere a più di un gruppo Inc. Vengono mostrati solo i gruppi Inc contenenti più di 10 plasmidi. Credito:Ricerca sugli acidi nucleici DOI:10.1093/nar/gkab859
CRISPR-Cas è diventato una specie di superstar negli ultimi dieci anni come strumento di editing genetico con un potenziale rivoluzionario, specialmente nelle scienze della salute. Originariamente noto come difesa immunitaria nei batteri, il CRISPR-Cas presente in natura si è dimostrato di natura più diversificata e versatile di quanto credessero i ricercatori scientifici. Ora, un gruppo di ricercatori del Dipartimento di Biologia dell'Università di Copenaghen ha studiato la prevalenza dei sistemi CRISPR-Cas nei plasmidi.
I ricercatori hanno esaminato più di 30.000 genomi plasmidici completi e hanno trovato CRISPR-Cas in circa il tre percento di essi, una percentuale elevata anche rispetto ai batteri. Hanno anche trovato vari rappresentanti di ben cinque dei sei tipi conosciuti di CRISPR-Cas nei genomi dei plasmidi studiati. I risultati dimostrano che i sistemi CRISPR-Cas sono sia diffusi che diversi nei plasmidi e, cosa interessante, che la stragrande maggioranza di essi prende di mira altri plasmidi.
"In parte, questo è eccitante perché supporta una comprensione più recente dei plasmidi come aventi un più alto grado di autonomia dalle loro cellule ospiti, tipicamente i batteri. Ma anche, perché a lungo termine, può aprire percorsi per combattere la virulenza e la resistenza nei batteri, che i plasmidi aiutano a diffondere", spiega Rafael Pinilla-Redondo, uno dei principali ricercatori dello studio e con sede presso il Dipartimento di Biologia dell'Università di Copenaghen.
CRISPR agisce come un GPS genomico, dove una memoria immagazzinata di frammenti di DNA estranei può essere utilizzata per localizzare un bersaglio per le proteine Cas, le "forbici genetiche". Nella maggior parte dei risultati dello studio, è stato il DNA di altri plasmidi a essere scoperto nella memoria immunitaria dei sistemi CRISPR-Cas, ad es. posto nel mirino.
Parte di un cambio di paradigma
Secondo i ricercatori, ciò suggerisce una lotta per le risorse tra i plasmidi, in cui i plasmidi servono i propri interessi lavorando attivamente per impedire ad altri plasmidi di accedere al batterio ospite in cui risiedono. In questa battaglia, usano CRISPR come arma.
I ricercatori hanno avuto l'opportunità di esaminare simultaneamente i batteri ospiti del set di dati di oltre 30.000 plasmidi per le stesse sequenze CRISPR-Cas. L'idea era di studiare se le sequenze trovate nei plasmidi rispecchiassero il contenuto di CRISPR nelle cellule ospiti, ma in genere non era così.
"I nostri risultati suggeriscono che i plasmidi hanno un alto grado di autonomia dai batteri in cui vivono. Sebbene i plasmidi dipendano dal loro ospite, sono anche entità geneticamente indipendenti che servono i propri interessi. Il loro diverso contenuto di CRISPR-Cas è un ottimo esempio di questa autonomia", afferma Rafael Pinilla-Redondo.
I nuovi risultati della ricerca contribuiranno a quello che i ricercatori considerano un cambio di paradigma in microbiologia. In microbiologia, flusso genico o trasferimento genico si riferisce a quando il materiale genetico si sposta tra le cellule, elementi genetici mobili mediati. Mentre alcuni elementi genetici mobili possono infiltrarsi, a beneficio di una cellula, altri vengono fermati perché dannosi. L'opinione comune è da tempo che i batteri controllano il flusso genico.
Il cambio di paradigma punta a comprendere dove i batteri svolgono effettivamente un ruolo molto meno importante nell'influenzare il flusso genico.
"Quelli che una volta si presumeva fossero batteri che combattevano per proteggersi dai parassiti genetici, come virus e plasmidi, è molto più complesso. Forse, dovrebbe essere meglio compreso come i parassiti che combattono tra loro, ad esempio, su quali dovrebbero essere autorizzati a vivi dietro l'orecchio di una mucca", spiega Rafael Pinilla-Redondo.
La possibilità di nuove armi contro la resistenza agli antibiotici
Le nuove conoscenze su come i plasmidi usano CRISPR possono avere un impatto su come combattere i batteri pericolosi in futuro. I plasmidi sono fondamentali per la diffusione di geni dannosi tra i batteri attraverso il cosiddetto trasferimento genico orizzontale.
La proliferazione del materiale genetico è fondamentale per la capacità dei batteri di adattarsi a nuovi ambienti e sfide. Da un batterio resistente agli antibiotici, un plasmide può copiare se stesso e trasferire quella proprietà ai batteri circostanti come parte del proprio DNA.
In quanto tali, le battaglie tra plasmidi possono aiutare i ricercatori a saperne di più su come combatterli.
"Capendo come i plasmidi competono tra loro, potremmo essere in grado di imparare come rallentarli e quindi rallentare la diffusione della resistenza agli antibiotici e delle proprietà virulente e dannose tra i batteri", afferma Søren Johannes Sørensen, professore di microbiologia e coautore di l'articolo di ricerca.
"A lungo termine, è possibile che saremo in grado di fare nostre le strategie dei plasmidi e usarle come strumenti. Senza prendere in prestito dalla natura, saremmo piuttosto limitati. Ma se potessimo conoscere i punti di forza e di debolezza del plasmidi da se stessi, sorgeranno opportunità", afferma.
Cosa significa CRISPR-Cas?
I frammenti di DNA (CRISPR) e le forbici proteiche Cas (ad es. Cas9) possono individuare sequenze di DNA specifiche e tagliarle.
Si prevede che CRISPR-Cas svolgerà un ruolo rivoluzionario come strumento di editing genetico, non ultimo nelle scienze della salute, per il trattamento di malattie genetiche, tra le altre cose.
I sistemi CRISPR erano originariamente visti come un sistema immunitario per i batteri, in particolare contro i virus. Tuttavia, molti ricercatori ora vedono CRISPR-Cas come uno strumento "Guns for Hire" che può essere utilizzato per una moltitudine di scopi, da molti attori diversi, inclusi batteri, plasmidi e esseri umani.
Cos'è un plasmide?
Un plasmide è una piccola molecola di DNA a forma di anello, un cosiddetto elemento genetico mobile, che si trova nei batteri e in alcuni altri tipi di microrganismi.
Ricorda i virus, poiché entrambi sono parassiti all'interno delle cellule. I plasmidi possono riprodursi indipendentemente dalla cellula ospite e spesso forniscono benefici alla cellula ospite.
Tra le altre cose, possono conferire o trasferire proprietà genetiche a un batterio, ad esempio rendendolo resistente agli antibiotici o patogeno, in un processo noto come trasferimento genico orizzontale.
I plasmidi sono da tempo uno strumento importante nella biologia molecolare per, tra le altre cose, la clonazione dei geni e l'introduzione di materiale genetico nelle cellule batteriche.
Che cos'è il trasferimento genico orizzontale?
Il trasferimento genico orizzontale è quando un organismo trasferisce i geni a un altro organismo che non è la sua stessa progenie.
In larga misura, la capacità dei batteri di adattarsi a nuovi ambienti e sfide dipende dalla fornitura di nuovi geni in questo modo.
Il fenomeno è responsabile dell'incombente crisi di resistenza agli antibiotici, poiché i batteri sviluppano rapidamente resistenza agli antibiotici acquisendo geni resistenti. È molto spesso mediato da plasmidi, rendendo la proliferazione dei plasmidi un problema di salute pubblica globale.
Informazioni sullo studio:i ricercatori hanno creato uno scanner CRISPR
Per studiare la prevalenza di CRISPR-Cas nei plasmidi, i ricercatori hanno utilizzato la più grande raccolta di genomi plasmidici completamente sequenziati, un set di dati compilato da ricercatori di tutto il mondo.
Per gestire le ingenti quantità di dati, i ricercatori del Dipartimento di Biologia hanno sviluppato un software per la scansione di parti CRISPR note. Il programma, denominato CRISPRCasTyper, da allora è stato reso disponibile gratuitamente ad altri ricercatori. + Esplora ulteriormente