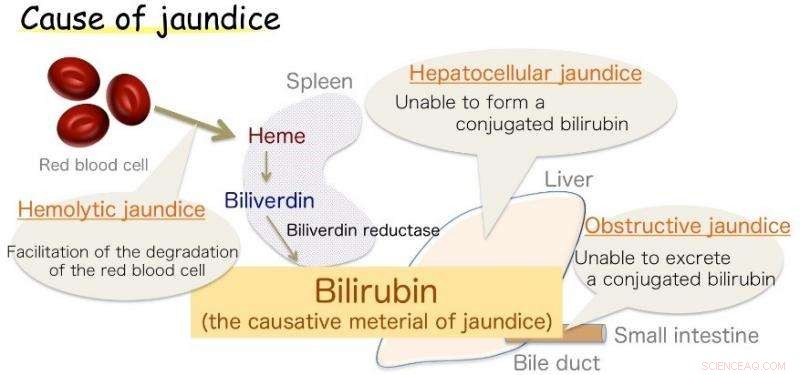
Fig.1:Causa dell'ittero. La bilirubina è il materiale causale dell'ittero. Credito:Università di Osaka
Un gruppo di ricerca giapponese che coinvolge l'Università di Osaka ha studiato la biliverdina reduttasi, l'enzima che produce la bilirubina – sostanza legata all'ittero – dalla biliverdina (BV). Sono state trovate due molecole di BV nel sito di reazione enzimatica, in un'insolita disposizione impilata. Gli esperimenti di mutazione hanno confermato quale amminoacido enzimatico fosse necessario per la produzione di bilirubina. Nel meccanismo proposto, questo amminoacido trasferisce l'idrogeno a una molecola di BV, usando l'altro BV come condotto. Questo aiuta la ricerca di farmaci anti-ittero.
Osaka – Ittero, segnato dall'ingiallimento della pelle, è comune nei neonati, ma anche un sintomo di varie malattie dell'adulto. Questa decolorazione è causata da un eccesso di bilirubina (BR), la sostanza che dà alla bile la sua sfumatura gialla. Però, BR è anche un antiossidante vitale, che a livelli sani protegge le cellule dai danni del perossido. La sua produzione nel corpo, anche se, è stata a lungo una fonte di incertezza.
Ora, una collaborazione di ricerca giapponese che coinvolge l'Università di Osaka crede di avere la risposta. Il BR è già noto per essere prodotto da una sostanza chimica correlata, biliverdina (BV), dall'enzima biliverdina reduttasi (BVR). L'enzima avvolge BV e trasferisce due atomi di idrogeno, uno positivo e uno negativo, per produrre l'antiossidante giallo. Però, i biologi non sono stati in grado di stabilire quale parte dell'enzima fosse chimicamente coinvolta nel processo (il sito attivo), o da dove proviene l'idrogeno positivo. I risultati sono stati recentemente riportati in Comunicazioni sulla natura .
"Studi precedenti hanno utilizzato BVR da ratti, e non potrebbe mai cristallizzare l'enzima abbastanza bene da determinare come si lega a BV, ", afferma il coautore dello studio Keiichi Fukuyama. "Ci siamo resi conto che lo stesso enzima nei batteri Synechocystis aveva una forma di piega quasi identica, ma era più facile da esaminare con la cristallografia a raggi X."
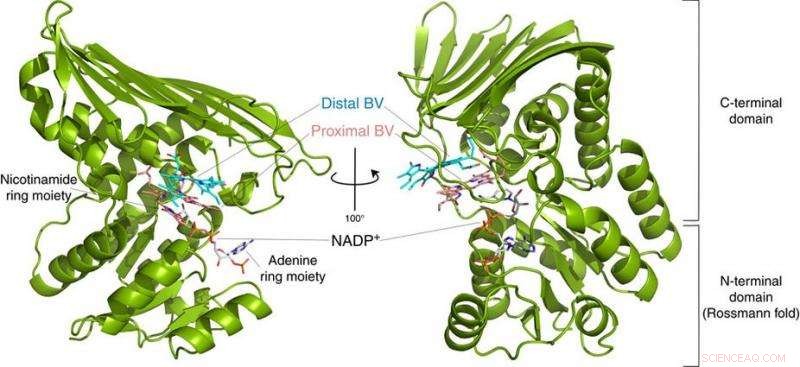
Fig.2:Struttura del BVR. Questa struttura ha rivelato che BVR lega due substrati di biliverdina (Distal BV e Proximal BV) allo stesso tempo. Credito:Università di Osaka
Con loro sorpresa, i ricercatori hanno trovato due molecole di BV - una impilata sull'altra - nel sito attivo, anche se solo uno viene convertito in BR. Dai dati radiografici, dedussero perché ne servivano due. Il primo BV, a causa della direzione verso cui è rivolto per ricevere l'idrogeno negativo, non può accettare l'idrogeno positivo direttamente dall'enzima. Anziché, il secondo BV funge da condotto dell'idrogeno per consentire il processo, ma non è esso stesso convertito in BR.
Dalla struttura, i ricercatori hanno proposto quale dei 328 amminoacidi dell'enzima fornisce effettivamente l'atomo di idrogeno positivo. Quindi, hanno eseguito esperimenti in cui gli enzimi sono stati mutati per rimuovere specificamente quell'amminoacido, lasciando intatte le altre. Gli enzimi risultanti, sia da batteri, ratti, o umani, non erano praticamente in grado di produrre BR. Ulteriori esperimenti hanno confermato che gli enzimi del ratto e dell'uomo utilizzavano anche due molecole di BV, proprio come i batteri.
"Un impilamento così accurato di due molecole di substrato durante i processi enzimatici è molto raro, " Dice Fukuyama. "Una migliore comprensione della produzione di BR non è entusiasmante solo per la biochimica, ma dovrebbe aiutarci a sviluppare farmaci per malattie caratterizzate da ittero grave da eccesso di BR, come l'epatite».
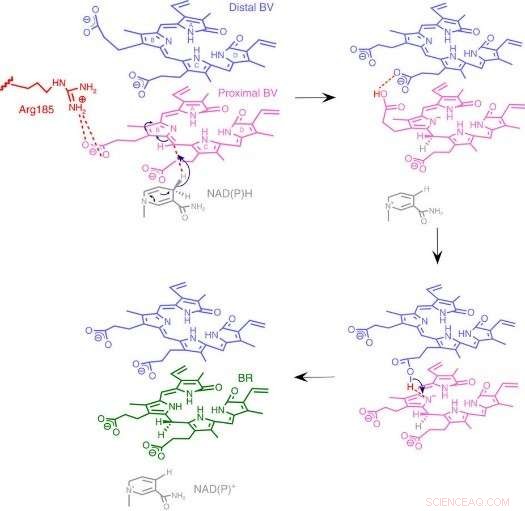
Fig.3:Meccanismo della reazione BVR. Proponiamo un meccanismo di reazione unico basato su una nuova struttura enzimatica in cui due substrati impilati si legano a una tasca catalitica. Credito:Università di Osaka