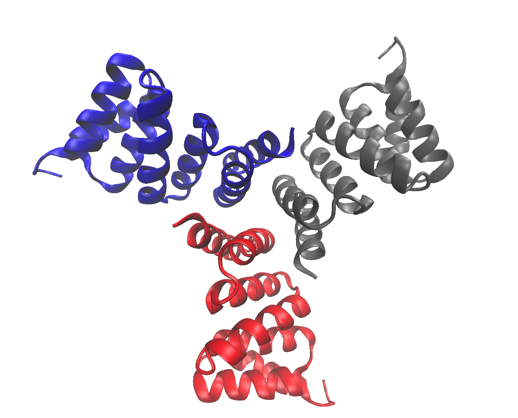
La struttura cristallina ad alta risoluzione di una delle proteine studiate, un trimero progettato computazionalmente. La struttura è stata depositata nella Protein Data Bank con numero di adesione 5HRZ. Credito:Lawrence Berkeley National Laboratory
Le proteine cicliche che si assemblano da più subunità identiche (omo-oligomeri) svolgono ruoli chiave in molti processi biologici, compresa la segnalazione cellulare e la catalisi enzimatica e la funzione proteica. I ricercatori della divisione di biofisica molecolare e bioimmagine integrata (MBIB) del Berkeley Lab hanno lavorato con David Baker dell'Università di Washington, che ha guidato un team per progettare in silico e cristallizzare proteine omo-oligomeriche cicliche autoassemblanti.
Prevedendo e progettando questi oligomeri di ordine superiore, Baker e il suo team hanno acquisito una comprensione dei principi fondamentali alla base delle interazioni oligomero-oligomero. Al di là delle interazioni interne della proteina stessa, questi oligomeri progettati possono essere utilizzati per esplorare questioni di base su come la struttura delle molecole di segnalazione influenzi il comportamento dei recettori e la risposta cellulare.
È stata sviluppata una strategia per progettare interfacce su proteine idealizzate allo scopo di dirigere il loro assemblaggio in complessi multimerici. I ricercatori del Berkeley Lab hanno utilizzato la caratterizzazione strutturale, sia la cristallografia a raggi X che la diffusione di raggi X a piccolo angolo (SAXS), per dimostrare che molti dei progetti adottavano lo stato di oligomerizzazione target e la struttura prevista. Il loro lavoro non solo dimostra che gli scienziati hanno una comprensione di base di ciò che determina l'oligomerizzazione, mostra anche che possono progettare proteine con forma sintonizzabile, dimensione, e simmetria per una varietà di applicazioni biologiche.
Parte del lavoro di cristallografia a raggi X incluso nel documento è stato eseguito sotto gli auspici del programma Crystallography Collective, che è gestito dal ricercatore Banumathi Sankaran presso l'Advanced Light Source. Il ricercatore Henrique Pereira ha cristallizzato le proteine progettate dai ricercatori dell'Università di Washington. Sankaran e Peter Zwart, scienziato del personale MBIB, raccolto dati cristallografici su Beamline 5.0.2 nel Berkeley Center for Structural Biology e risolto le strutture. Per ottenere informazioni sulle dinamiche proteiche progettate, Kathryn Burnett e Greg Hura di MBIB hanno eseguito SAXS sulla linea di luce SIBYLS.
Pereira, sancarano, e Zwart sono stati coautori di diversi articoli con Baker e il suo team, tutto ciò segue un tema di progettazione delle proteine e validazione della struttura.
"Gli omo-oligomeri ciclici svolgono ruoli importanti nella funzione biologica, " ha detto Sankaran. "Qui abbiamo un altro progetto sintetico che ha dimostrato di corrispondere al progetto computazionale sia con gli studi di soluzioni ad angolo ridotto che con la diffusione dei raggi X".
Questo lavoro, insieme al foglio beta curvo e ai progetti di metalloproteine trimeriche, ampliare le possibilità di sviluppo di nuove terapie e biomateriali.