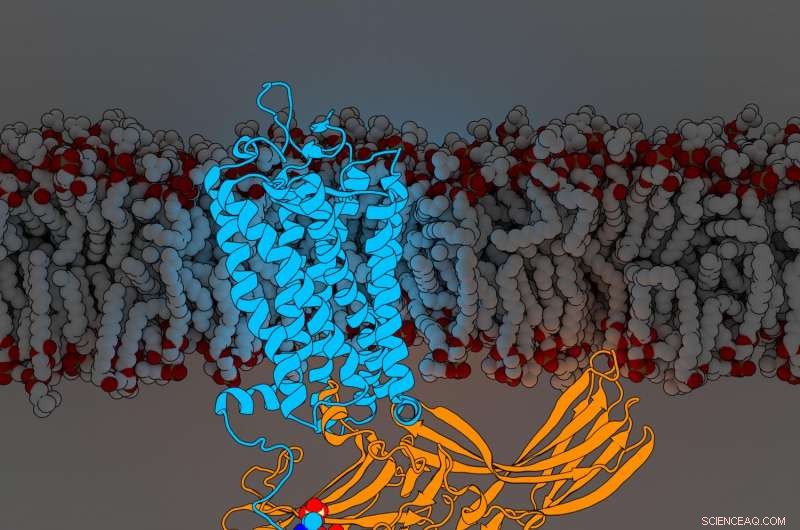
Rodopsinaarrestina. Credito:Parker de Waal, Laboratorio Xu, Istituto di ricerca Van Andel
Un team guidato dagli scienziati del Van Andel Research Institute ha risposto a una domanda di vecchia data che potrebbe portare a farmaci più efficaci con meno effetti collaterali per malattie che vanno dall'insufficienza cardiaca al cancro.
Le scoperte, pubblicato oggi in Cellula , rivelano per la prima volta i componenti di un recettore accoppiato a proteine G (GPCR) chiamato rodopsina legato a una molecola di segnalazione chiamata arrestina, entrambi i pezzi cruciali dell'intricata rete di comunicazione cellulare del corpo. La nuova scoperta affina ulteriormente un punto di riferimento 2015 Natura articolo che per primo ha descritto la struttura delle due molecole in complesso insieme.
"La nostra struttura rivista è come una tabella di marcia con dettagli aggiuntivi e caratteristiche geografiche compilate, " ha detto il professor VARI H. Eric Xu, dottorato di ricerca, l'autore principale del nuovo studio e dell'articolo del 2015. "Per anni, il campo ha cercato di rispondere esattamente a come le arrestine interagiscono con i GPCR. Ci auguriamo che la risposta fornita dal nostro lavoro, nel contesto della rodopsina, alimenterà la nuova ricerca e la progettazione di farmaci migliori, a beneficio dei pazienti di tutto il mondo".
I GPCR sono il più grande gruppo di recettori della superficie cellulare, e fungono da centri di scambio di informazioni collegandosi con arrestine o altre molecole di segnalazione chiamate proteine G per trasmettere istruzioni critiche per innumerevoli funzioni biologiche, compresa la crescita e la regolazione ormonale. Queste caratteristiche, insieme alla loro posizione sulla superficie della cellula, renderli bersagli attraenti per la terapia farmacologica. Si stima che il 30% di tutti i farmaci attualmente sul mercato si rivolgono ai GPCR.
"Poiché le arrestine e le proteine G mediano diverse risposte cellulari, lo sviluppo di farmaci che attivano solo uno di questi due percorsi può produrre meno effetti collaterali per i pazienti, " ha detto Karsten Melcher, dottorato di ricerca, un autore senior dell'articolo e professore associato al VARI. "L'intuizione fornita dalla nostra struttura ampliata potrebbe fare molto per guidare la progettazione di queste terapie".
Per determinare la loro struttura aumentata, Edward Zhou, ricercatore senior di Xu Lab, dottorato di ricerca, rianalizzati più di 22, 000 immagini singole raccolte per lo studio originale del 2015 utilizzando un software migliorato non disponibile al momento. Ha rivelato tre componenti molecolari precedentemente nascosti chiamati gruppi fosforilici sulla rodopsina e tre tasche corrispondenti sull'arrestina che fungono da docking station. La disposizione specifica di questi gruppi fosforilici, noti come codici di fosforilazione, è necessaria affinché la rodopsina si leghi all'arrestina, molto simile alla combinazione di una cassaforte. Una volta completato, questa interazione avvia un ramo di una complessa rete di comunicazione cellulare che regola le funzioni in tutto il corpo.
"La grande domanda poi è diventata, 'Se questo sta accadendo con rodopsina e arrestina, succede in tutti i GPCR?'", ha detto Parker de Waal, uno studente del Van Andel Institute Graduate School e membro del laboratorio di Xu. "I nostri risultati indicano che questi codici - queste sequenze specifiche di gruppi fosforilici - si trovano in tutto o in parte nella maggior parte dei GPCR. I risultati aiutano ad affrontare elegantemente una domanda di vecchia data nel nostro campo:perché alcuni GPCR legano le arrestine meglio di altri ora può essere spiegato dall'esistenza di codici di fosforilazione."
Non esisteva uno strumento per esplorare la prevalenza di questi codici tra i dati GPCR annotati, così de Waal ne ha creato uno. In parte GUI Web e in parte strumento da riga di comando basato su Python, PhosCoFinder ha permesso al team di cercare rapidamente nell'insieme totale di tutti i GPCR conosciuti e di prevedere potenziali codici di fosforilazione.
Come previsto, è stato riscontrato che più della metà degli 825 GPCR scansionati da PhosCoFinder contengono codici di fosforilazione all'interno della coda C-terminale, una parte del GPCR che aiuta a trasferire le informazioni dall'ambiente della cellula all'interno della cellula. Anche la maggior parte dei restanti GPCR è risultata dotata di codici; però, erano situati in aree diverse dalle loro code C-terminali, possibilmente influenzando il modo in cui si legano alle arrestine. I prossimi passi, Xu dice, devono indagare se questi risultati sono validi per tutti i GPCR e altre proteine della superficie cellulare che interagiscono con l'arrestina.
"Con la biologia, c'è sempre più di un modo di fare le cose, " ha detto Xu. "Vogliamo seguire anche queste altre strade nella speranza che ci aiutino a comprendere ulteriormente questi meccanismi critici".