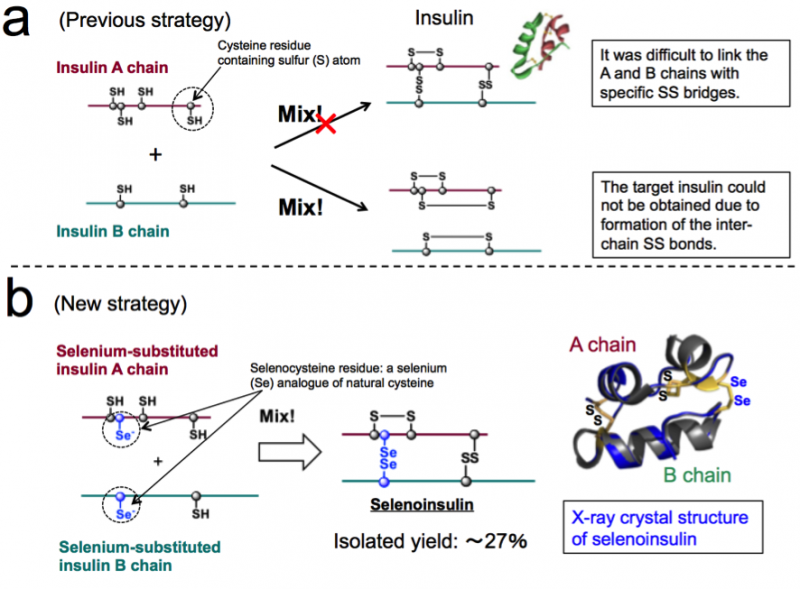
Figura 1. Sintesi chimica dell'insulina. (a) Strategia precedente basata sull'accoppiamento tra le catene A e B dell'insulina nativa. (b) Nuova strategia che sfrutta la natura unica della selenocisteina e la struttura cristallina a raggi X della selenoinsulina. (Queste cifre sono citate dall'articolo originale con modifiche.). Credito:Università di Osaka
Un gruppo di ricercatori ha sviluppato analoghi sintetici dell'insulina selenoinsulina (Se-Ins) attraverso la sostituzione del disolfuro intercatena nell'insulina pancreatica bovina (BPIns) con un ponte diselenide.
Questo gruppo ha dimostrato che le Se-Ins avevano una struttura e una bioattività quasi identiche paragonabili a quelle delle BPins, e che aveva una maggiore resistenza alla degradazione dell'IDE. Ciò è promettente per l'applicazione di Se-Ins a una preparazione di insulina di lunga durata nella terapia del diabete.
Dopo aver circolato nel flusso sanguigno, l'insulina viene degradata da un enzima di degradazione dell'insulina (IDE) nel rene ed escreta nelle urine. Questo gruppo pensava che la produzione di insulina con elevata resistenza alla degradazione da parte dell'IDE avrebbe portato allo sviluppo di un nuovo tipo di preparati insulinici di lunga durata che potevano circolare nel corpo per lungo tempo.
L'insulina è costituita da due catene polipeptidiche:catena A e catena B, collegati da un legame disolfuro (legame Se-Se), quindi è difficile prendere l'insulina solo da queste catene a causa dei legami Se−Se. Così, questo gruppo pensava che se le catene A e B dell'insulina contenenti selenio (Se) invece di zolfo (S), erano abituati, il legame diselenide (legame Se-Se) si formerebbe rapidamente e quindi la reazione di assemblaggio della catena potrebbe essere eseguita in modo efficiente, poiché Se è più reattivo di S.
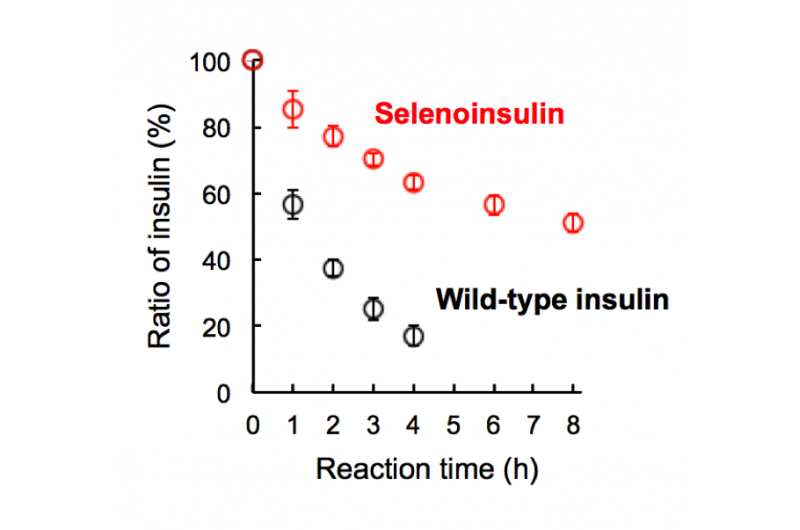
Figura 2. Degradazione della selenoinsulina (rossa) e dell'insulina wild-type (nera) da parte dell'enzima di degradazione dell'insulina (IDE). (Questa cifra è stata citata dall'articolo originale con lievi modifiche.). Credito:Università di Osaka
Inoltre, I legami Se-Se sono più stabili dei legami S-S, quindi questo gruppo ha anticipato che i legami Se-Se avrebbero conferito una maggiore robustezza strutturale alla piega dell'insulina, determinando così una maggiore resistenza alla degradazione dell'IDE grazie alla sua stabilità intrinseca. Sulla base di questo concetto, questo gruppo è riuscito a sintetizzare catene di insulina A e B contenenti Se, nonché ottenere Se-In con una resa di isolamento fino al 27% facendo reagire catene peptidiche in condizioni ottimali.
Questo gruppo ha dimostrato che Se-Ins aveva una struttura quasi identica a quella di BPIns, suggerendo che Se-Ins ha una bioattività paragonabile a quella di BPIns. Esperimenti di degradazione di BPIn e Se-In utilizzando IDE hanno mostrato che il tasso di degradazione di Se-Ins era molto più lento di quello di BPIn. Da questa, si pensa che Se-Ins abbia una natura di lunga durata e potrebbe essere una nuova classe di analoghi dell'insulina ad azione prolungata per la terapia del diabete.
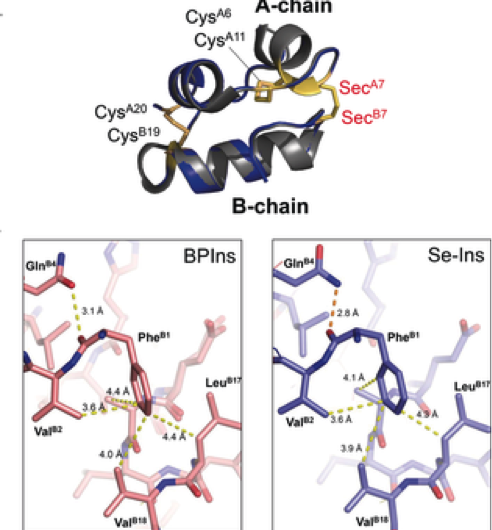
Figura 3. Preparazione della selenoinsulina come analogo dell'insulina a lunga durata. Credito:Università di Osaka