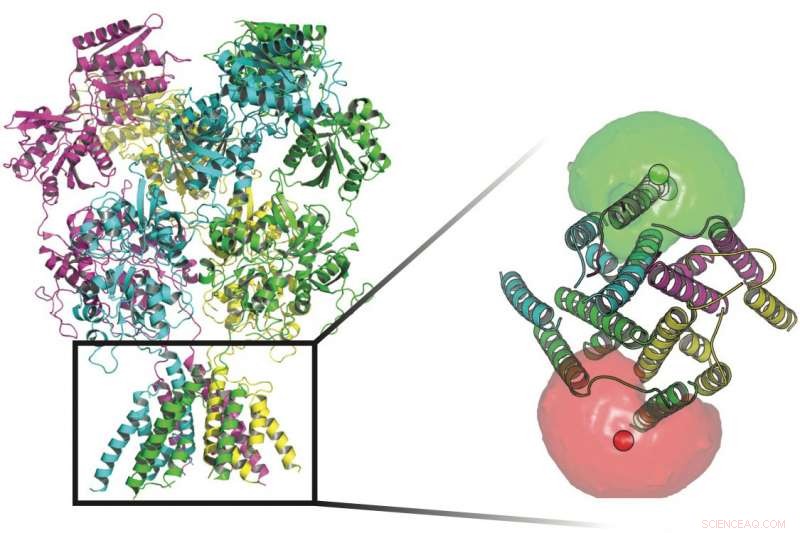
Gli scienziati della Rice University e dell'UTHealth hanno monitorato le conformazioni delle proteine che fanno la guardia ai canali transmembrana nelle pareti delle cellule nervose. Alla base delle proteine in questa immagine ci sono fluorofori (sfere rosse e verdi) circondate da nuvole di fluorofori che hanno aiutato i ricercatori a definire i movimenti del cancello che consente agli ioni di fluire attraverso la membrana. Credito:Rice University/UTHealth
La capacità di tracciare i movimenti delle singole molecole ha rivelato come le proteine sulla superficie delle cellule nervose controllino le porte che trasformano i segnali chimici in segnali elettrici. La scoperta è un passo avanti nel dettagliare i meccanismi coinvolti nella malattia neurologica, secondo i ricercatori della Rice University e dell'Università del Texas Health Science Center di Houston (UTHealth).
Utilizzando sofisticati metodi di imaging e statistici, gli scienziati hanno impiegato tecniche di imaging FRET a singola molecola per stabilire una testa di ponte al cancello del recettore NMDA che, quando attivato, permette agli ioni di fluire attraverso la membrana della cellula nervosa.
FRET sta per trasferimento di energia di risonanza di Förster. È un modo per usare la luce emessa da due molecole fluorescenti come un righello sensibile per distanze molto piccole, come l'apertura nel canale del recettore NMDA.
Il chimico del riso Christy Landes, un esperto in FRET a singola molecola, e Vasanthi Jayaraman, un professore di biochimica e biologia molecolare presso la McGovern Medical School di UTHealth, la cui esperienza è nella biochimica dei recettori NMDA, hanno collaborato per raccogliere le prime prove sperimentali che descrivono in dettaglio le dinamiche di come i recettori alterano le loro forme per controllare la sensibilità del cancello ai segnali chimici. Il nuovo studio appare in Natura chimica biologia .
Il recettore NMDA è costituito da quattro subunità proteiche, ciascuno con quattro domini, e ciascuno di questi domini ha una funzione particolare. Collettivamente, attraversano la membrana cellulare. Ogni subunità può avere molti "stati, "o forme, che regolano quali segnali elettrici, e quanti di essi, passano attraverso. Le subunità siedono su ciascun lato del canale e si attivano quando legano i ligandi dei neurotrasmettitori sia glutammato che glicina e attivano la via di segnalazione che consente agli ioni caricati positivamente di passare nella cellula.
"Questi recettori sono fondamentali per la normale funzione fisiologica, " Jayaraman ha detto. "Un sacco di volte potresti non voler attivare o disattivare la segnalazione. Potresti voler comporre l'estensione della segnalazione. Una volta compresi tutti gli stati della proteina, possiamo iniziare a pensare a come farlo, mantenendo così la proteina attiva ma a vari livelli secondo necessità.
"È importante per lo sviluppo dei farmaci comprendere queste dinamiche perché i movimenti e le proprietà energetiche di queste proteine determinano le loro funzioni specifiche, " ha detto. "Siamo stati in grado di fare entrambe le cose."
Questa conoscenza potrebbe portare a farmaci multifunzionali che influenzano i canali in modi sottili, disse Landes. Gli antagonisti del recettore NMDA noti includono anestetici comuni, oppiacei sintetici come il metadone e farmaci dissociativi come la ketamina e il protossido di azoto. La funzione depressa del recettore NMDA è sospettata nei deficit di memoria comunemente associati all'invecchiamento. È noto che l'alcol inibisce il glutammato, uno dei due neurotrasmettitori che si legano a NMDA.

Le quattro subunità delle proteine del recettore NMDA possono avere ciascuna molti stati che regolano quali segnali elettrici passano attraverso la membrana di una cellula nervosa. Le subunità si attivano quando legano i ligandi dei neurotrasmettitori sia glutammato che glicina e attivano la via di segnalazione che consente agli ioni caricati positivamente di passare nella cellula. Credito:Rice University/UTHealth
"Molta progettazione di farmaci ha come principio fondamentale che c'è un modo per legare, e in pratica o accendi o spegni qualcosa, " Landes ha detto. "Ma è ovvio che questo tipo di recettore proteico non è solo acceso o spento. Esistono molteplici interazioni conformazionali che migliorano o degradano la segnalazione".
In uno studio precedente, il team ha analizzato le conformazioni di un sistema più piccolo e semplice ma correlato, il dominio di legame dell'agonista simile al morsetto C di un altro recettore, AMPA. AMPA media la trasmissione veloce del segnale nel sistema nervoso centrale. La tecnica FRET a singola molecola ha permesso ai ricercatori di ottenere le prime istantanee delle varie conformazioni del morsetto della proteina AMPA a riposo e anche quando è legata a una gamma di molecole bersaglio misurando la distanza tra due tag molecolari attivati dalla luce.
Questa volta, i ricercatori hanno cercato di capire l'apertura del canale stesso, ovvero come le proteine che compongono il canale del recettore NMDA si muovono per attivare la porta ionica. Aggiungendo tag fluorescenti attraverso il canale e campionandoli nel tempo, sono stati in grado di mappare il panorama energetico del segmento transmembrana della proteina nel suo stato di riposo o sotto l'influenza di ligandi che modulano il gate tra aperto, stati chiusi e intermedi. Lo stato strutturale di ogni canale influenza direttamente i segnali elettrici che possono passare.
Hanno scoperto che lo stato libero da agonisti (a riposo) è strutturalmente rigido, che confermava la sua energica resistenza all'adozione di conformazioni che consentissero l'apertura del canale. Gli agonisti come il glutammato sono le sostanze chimiche bersaglio che attivano il trasporto del segnale elettrico attraverso il canale. I ricercatori hanno confermato che in presenza dell'agonista primario, il canale NMDA era meno rigido e quindi in grado di transitare più facilmente tra le possibili conformazioni canale-aperto.
Il lavoro ha anche mostrato come due modulatori noti per interagire con parti diverse della conformazione e rigidità del canale di impatto completo del recettore. ioni di zinco, nonostante si leghi alla porzione extracellulare del recettore lontano dal canale, indurre un canale rigido con significative barriere energetiche all'apertura, simile allo stato di riposo del recettore. In contrasto, è stato scoperto che la dizocilpina "bloccante dei pori" migliora l'energia delle transizioni tra più conformazioni che non si riferiscono all'apertura del canale.
Landes ha detto che invece di catturare stati statici, come si fa tipicamente con i raggi X, "Stavamo osservando i cambiamenti di distanza attraverso il canale in modo dinamico. È molto più complicato". Ciò ha fornito loro un set di dati più simile a un film che a un'istantanea, lei disse.
Ha detto che lo studio richiedeva nuove tecniche per purificare e stabilizzare le proteine complete, che sono stati prelevati dai neuroni dei roditori. "C'erano tre elementi chiave in questo progetto:gestire le proteine complete, ottenerli purificati ed etichettati a livello di singolo recettore ed eseguire l'analisi dei dati per scoprire cosa significa.
"Questo è davvero il fondamento qui, " ha detto. "Ora possiamo fare queste misurazioni per sistemi molto più complicati."