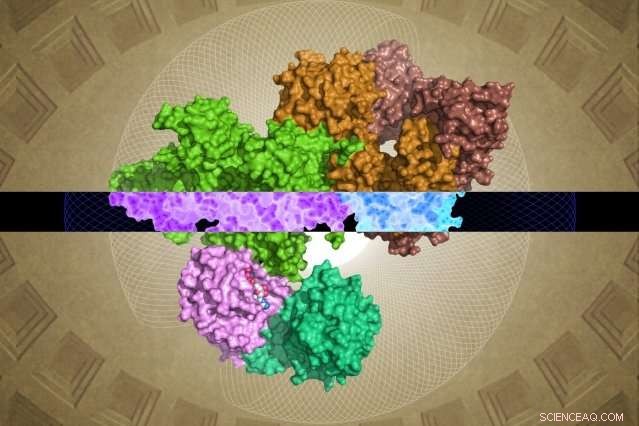
La struttura GATOR1 generata da cryo-EM può fornire approfondimenti sulla sua funzione. Credito:Steven Lee/Whitehead Institute
Un team di ricercatori del Whitehead Institute e dell'Howard Hughes Medical Institute ha rivelato la struttura di un complesso proteico chiave nell'uomo che trasmette segnali sui livelli di nutrienti, consentendo alle cellule di allineare la loro crescita con la fornitura di materiali necessari per supportare tale crescita. Questo complesso, chiamato GATOR1, agisce come una sorta di interruttore on-off per i segnali di "crescita" (o "non crescere") che fluiscono attraverso un percorso di crescita cellulare critico noto come mTORC1.
Nonostante la sua importanza, GATOR1 ha poche somiglianze con le proteine note, lasciando grandi lacune nella comprensione da parte degli scienziati della sua struttura e funzione molecolare. Ora, come descritto online il 28 marzo sulla rivista Natura , Gli scienziati di Whitehead e i loro colleghi hanno generato il primo quadro molecolare dettagliato di GATOR1, rivelando un gruppo di proteine altamente ordinato e un'interazione estremamente insolita con il suo partner, il Rag GTPase.
"Se sai qualcosa sulla struttura tridimensionale di una proteina, quindi puoi fare alcune ipotesi informate su come potrebbe funzionare. Ma GATOR1 è stato fondamentalmente una scatola nera, ", afferma l'autore senior David Sabatini, un membro del Whitehead Institute, un professore di biologia al MIT, e ricercatore presso l'Howard Hughes Medical Institute (HHMI). "Ora, per la prima volta, abbiamo generato immagini ad alta risoluzione di GATOR1 e possiamo iniziare a sezionare come funziona questo complesso proteico critico".
GATOR1 è stato identificato per la prima volta circa cinque anni fa. Consiste di tre subunità proteiche (Depdc5, Nprl2, e Nprl3), e le mutazioni in queste subunità sono state associate a malattie umane, compresi i tumori e le condizioni neurologiche come l'epilessia. Però, a causa della mancanza di somiglianza con altre proteine, la maggior parte del complesso GATOR1 è un mistero molecolare. "GATOR1 non ha domini proteici ben definiti, " spiega il ricercatore di Whitehead Kuang Shen, uno dei primi autori dello studio. "Così, questo complesso è davvero molto speciale e anche molto impegnativo da studiare."
A causa delle grandi dimensioni del complesso e della relativa flessibilità, GATOR1 non può essere prontamente cristallizzato, un passaggio necessario per risolvere la struttura proteica attraverso standard, Metodi cristallografici a raggi X. Di conseguenza, Shen e Sabatini si sono rivolti a Zhiheng Yu di HHMI. Yu e il suo team sono specializzati in microscopia crioelettronica (crio-EM), una tecnica emergente che promette di visualizzare le strutture molecolari di grandi proteine e complessi proteici. È importante sottolineare che non utilizza cristalli proteici. Anziché, le proteine vengono rapidamente congelate in un sottile strato di ghiaccio vetrificato e quindi riprese da un fascio di elettroni veloci all'interno di una colonna di microscopio elettronico.
"Negli ultimi dieci anni ci sono stati alcuni importanti progressi nella tecnologia crio-EM, e adesso, è possibile ottenere una risoluzione atomica o quasi atomica per una varietà di proteine, " spiega Yu, un autore senior del documento e direttore di HHMI ha condiviso, struttura di crio-EM all'avanguardia presso il Janelia Research Campus. Il premio Nobel per la chimica dell'anno scorso è stato assegnato a tre scienziati per i loro sforzi pionieristici nello sviluppo della crio-EM.
GATOR1 si è rivelato un argomento spinoso, anche per crio-EM, e ha richiesto alcuni tentativi ed errori da parte di Yu, Shen, e i loro colleghi per preparare campioni che potrebbero fornire solide informazioni strutturali. Inoltre, il lavoro della squadra è stato reso ancora più difficile dalla forma unica del complesso. Senza la minima idea della struttura potenziale di GATOR1, Shen e i suoi colleghi, tra cui il coautore Edward Brignole del MIT, dovuto derivarlo completamente da zero.
Tuttavia, il team Whitehead-HHMI è stato in grado di risolvere strutture quasi complete per GATOR1 e per GATOR1 legate alle sue proteine partner, i Rag GTPasi. (Due regioni della subunità Depdc5 sono altamente flessibili e quindi non possono essere risolte.) Da questa ricchezza di nuove informazioni e dalle successive analisi biochimiche del team, sono emersi alcuni risultati sorprendenti.
Il primo è il notevole livello di organizzazione di GATOR1. La proteina è estremamente ben organizzata, che è abbastanza insolito per le proteine che non hanno strutture previste. (Tali proteine sono di solito abbastanza disorganizzate.) Inoltre, i ricercatori hanno identificato quattro domini proteici che non erano mai stati visualizzati prima. Questi nuovi motivi, chiamati NTD, SABA, SHEN, e CTD, potrebbero fornire informazioni cruciali sul funzionamento interno del complesso GATOR1.
Shen, Sabatini, ei loro colleghi hanno scoperto un'altra sorpresa. A differenza di altre proteine che si legano alle Rag GTPasi, GATOR1 contatta queste proteine in almeno due siti distinti. Inoltre, uno dei siti di legame serve a inibire, piuttosto che a stimolare, l'attività della Rag GTPasi. "Questo tipo di doppio legame non è mai stato osservato:è molto insolito, " Dice Shen. I ricercatori ipotizzano che questa caratteristica sia uno dei motivi per cui GATOR1 è così grande, perché deve contenere il suo Rag GTPase in più siti, piuttosto che uno, come la maggior parte delle altre proteine di questo tipo.
Nonostante queste sorprese, i ricercatori riconoscono che le loro analisi hanno appena iniziato a scalfire la superficie di GATOR1 e i meccanismi attraverso i quali regola la via di segnalazione di mTOR.
"C'è ancora molto da scoprire in questa proteina, "dice Sabatini.
Questa storia è stata ripubblicata per gentile concessione di MIT News (web.mit.edu/newsoffice/), un popolare sito che copre notizie sulla ricerca del MIT, innovazione e didattica.