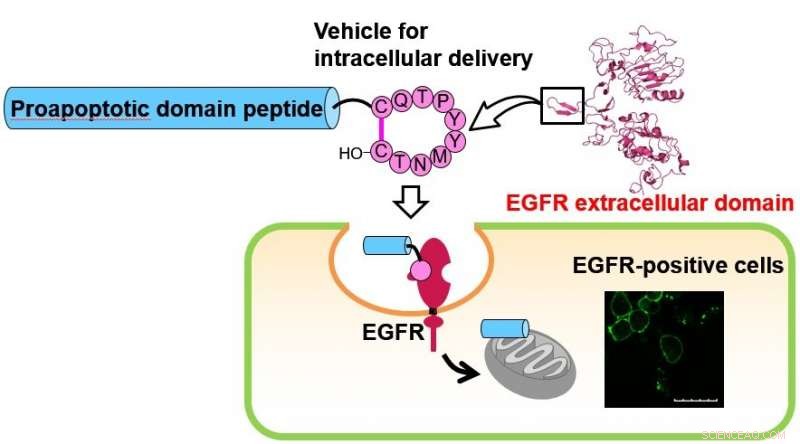
Decapeptide ciclico, che imita il braccio di dimerizzazione del recettore EGF (EGFR), è stato precedentemente trovato per essere catturato nelle cellule. Gli autori hanno scoperto il potenziale promettente di questo peptide come veicolo di somministrazione intracellulare diretto alle cellule EGFR-positive. La consegna cellulare del peptide del dominio proapoptotico (PAD) è stata messa in discussione dalla coniugazione con il peptide ciclico di cui sopra. L'assorbimento cellulare del peptide coniugato, che era composto dal peptide ciclico, il peptide PAD e un linker scindibile con una proteasi, è stata valutata mediante trattamento di cellule EGFR-positive. Una significativa soppressione della proliferazione da parte del peptide coniugato è stata dimostrata in un saggio di vitalità cellulare. Credito:Dipartimento di Chimica Farmaceutica, TMDU
Nel campo delle terapie antitumorali, i peptidi antimicrobici cationici (AMP) hanno acquisito importanza a causa della loro attività citotossica e antitumorale nelle cellule tumorali resistenti ai farmaci. I peptidi sono composti costituiti da due o più amminoacidi legati in una catena.
Un peptide di dominio proapoptotico impermeabile alla membrana (PAD) [KLAKLAK]2 è noto per essere un agente antimicrobico e causare la rottura della membrana mitocondriale, seguita dalla morte cellulare. La maggior parte degli AMP, incluso il PAD, ha funzioni antitumorali a causa di un sistema di difesa dell'ospite multifunzionale di organismi multicellulari; però, non possono penetrare nelle membrane cellulari, e solo, hanno poca citotossicità.
Precedenti studi hanno mostrato che i peptidi PAD entrano nelle cellule mediante la loro coniugazione con i peptidi che penetrano nelle cellule (CPP). Un team di ricercatori della Tokyo Medical and Dental University (TMDU) ha mostrato un decapeptide ciclico, chiamato peptide 1, imita il braccio di dimerizzazione del recettore EGF (EGFR). L'EGFR è coinvolto nella trasduzione del segnale cellulare e nella progressione del cancro, ed è sovraespresso in molte cellule tumorali. Quindi, il legame del peptide 1 all'EGFR potrebbe potenzialmente ritardare la crescita del cancro.
Nel suo ultimo studio, il team mirava a verificare la selettività del peptide 1 all'EGFR e ne ha studiato l'efficacia come veicolo per la consegna intracellulare alle cellule. I ricercatori hanno riportato il loro studio in Chimica dei bioconiugati .
"Come studio di prova del concetto, la consegna cellulare del peptide PAD è stata sfidata dalla coniugazione con il peptide 1, " spiega il primo autore dello studio Kei Toyama. "L'assorbimento cellulare di un peptide coniugato 2, composto da peptide 1, il peptide PAD, e un linker scindibile con una proteasi, è stata valutata mediante il trattamento di una linea cellulare di cancro del polmone EGFR-positiva."
Una significativa soppressione della proliferazione da parte del peptide 2 è stata osservata nei saggi di vitalità cellulare, considerando che coniugato 3, che non contiene il peptide 1, non avevano attività significativamente inibitoria nelle linee cellulari. In particolare, il peptide PAD da solo non ha avuto effetto sulle cellule.
"I nostri risultati suggeriscono che il peptide 1 è un promettente composto guida come nuovo veicolo di somministrazione intracellulare per peptidi terapeuticamente efficaci, " dice l'autore senior Hirokazu Tamamura. "Inoltre, coniugato 2, con la sua attività di induzione dell'apoptosi, può essere esplorato come un nuovo peptide apoptotico che potrebbe contribuire allo sviluppo di reagenti antitumorali basati sulle funzioni dell'AMP".