Credito:Wiley
Alcune piccole cellule diverse dal resto possono avere un grande effetto. Per esempio, le singole cellule tumorali possono essere resistenti a una chemioterapia specifica, causando una ricaduta in un paziente che altrimenti sarebbe guarito. Nel diario Angewandte Chemie , gli scienziati hanno ora introdotto un chip basato sulla microfluidica per la manipolazione e la successiva analisi dell'acido nucleico delle singole cellule. La tecnica utilizza campi elettrici locali per "intrappolare" le cellule in modo altamente efficiente (dielettroforesi).
Le analisi molecolari delle singole cellule sono necessarie per comprendere meglio il ruolo delle popolazioni cellulari eterogenee nello sviluppo delle malattie e per sviluppare terapie efficaci per la medicina personalizzata. Identificare le singole cellule in una massa di altre cellule è una sfida enorme nella medicina diagnostica. Le celle devono essere ordinate, tenuto, trasferita in un altro recipiente di volume estremamente ridotto ( <1 μL) e quindi devono essere sottoposti ad analisi molecolare. I metodi convenzionali di solito richiedono molto tempo e sono complessi, oltre che inaffidabile e inefficiente. Possono anche compromettere la vitalità delle cellule, richiedono grandi volumi di campioni, hanno un alto rischio di contaminazione, e/o richiedono strumenti costosi.
Scienziati dell'Università di Washington (Seattle, STATI UNITI D'AMERICA), Iowa State University (Ames, STATI UNITI D'AMERICA), e Fred Hutchinson Cancer Research Center (Seattle, USA) hanno utilizzato la tecnologia microfluidica per superare questi problemi. Tutti i passaggi necessari avvengono in modo affidabile su un microchip appositamente sviluppato utilizzando quantità minime di solvente e senza richiedere la marcatura delle celle. A differenza dei tradizionali chip microfluidici, questo non richiede né una tecnologia di fabbricazione complessa né componenti come valvole o agitatori.
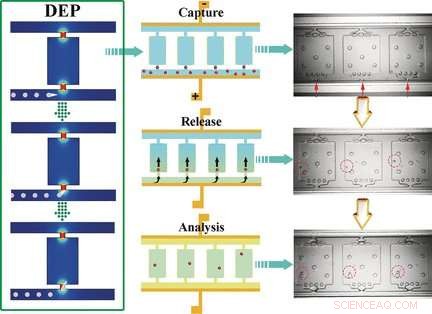
Il chip di auto-digitalizzazione dielettroforetico (SD-DEP) ha le dimensioni di una moneta e ha due microcanali paralleli (50 μm di profondità x 35 μm di larghezza x 3,2 cm di lunghezza) collegati da numerose piccole camere. Le aperture dei microcanali sono larghe solo 15 μm. Un elettrodo sottile è allungato lungo la lunghezza dei canali. I canali e le camere sono riempiti con un tampone, viene applicata una tensione alternata, e il campione viene aggiunto a uno dei microcanali. Il team guidato da Robbyn K. Anand e Daniel T. Chiu ha utilizzato cellule leucemiche nei loro esperimenti.
I massimi locali del campo elettrico si verificano agli stretti ingressi delle camere. Le cellule che entrano nelle camere sono "intrappolate". Poiché le dimensioni dell'ingresso sono simili alla dimensione media di una cella, solo una singola cella può essere intrappolata da ogni ingresso della camera. Quando si interrompe la corrente alternata e si aumenta la portata mediante iniezione dei reagenti necessari per le analisi successive, le cellule vengono lavate nelle camere. Viene quindi aggiunto un olio per sigillare le camere. Le cellule vengono quindi dissolte, e gli acidi nucleici vengono rilasciati e moltiplicati e possono essere identificati come cellule leucemiche da un gene marcatore.
Negli studi futuri, i ricercatori sperano di utilizzare il chip per determinare la distribuzione delle mutazioni genetiche che sono correlate alla resistenza nelle cellule leucemiche e quindi possono causare ricadute.