
Credito:Università di Leiden
Dopo quasi quattro decenni, I chimici di Leiden ed Eindhoven hanno risolto la discussione sul modello corretto per quanto riguarda la più semplice reazione chimica in catalisi eterogenea, che è essenziale per le celle a combustibile. Utilizzando un'esclusiva superficie curva in platino, Ludo Juurlink e Ph.D. il candidato Richard van Lent di Leiden e Michael Gleeson di DIFFER hanno mostrato quale modello descrive correttamente la reazione dell'idrogeno. Hanno pubblicato i loro risultati in Scienza l'11 gennaio.
Da quasi quattro decenni c'è un acceso dibattito nella letteratura chimica:quale dei due modelli esistenti per la reazione dell'idrogeno a un catalizzatore al platino è corretto (vedi riquadro)? I metodi tradizionali non erano sufficienti per dimostrarlo. Il chimico di Leiden Ludo Juurlink e Michael Gleeson dell'Istituto olandese per la ricerca sull'energia fondamentale (DIFFER) hanno deciso di sviluppare un nuovo metodo per fornire prove conclusive, che si è rivelato vincente.
I due modelli esistenti per la catalisi eterogenea danno previsioni diverse su come la reazione dell'idrogeno dipende dalla struttura della superficie del platino. Mediante misurazioni i ricercatori hanno potuto determinare la reattività dell'idrogeno e quindi dimostrare quale modello è corretto. Il cristallo di platino curvo è stato fondamentale per questo, che è stato realizzato per la prima volta dalla società olandese a Zaandam. "Poiché la superficie di platino è curva, la struttura atomica cambia molto gradualmente lungo la superficie, " spiega Juurlink. "Puoi paragonare questa struttura a una scala, i cui gradini verso i bordi si fanno sempre più stretti. Al centro sembra più una sala da ballo." Si è scoperto che la reattività dell'idrogeno dipendeva linearmente dalla vicinanza tra i gradini. Più i gradini erano distanti, l'idrogeno meno reattivo era. "E quindi il modello che prevedeva un comportamento non lineare non è corretto, " lui dice.
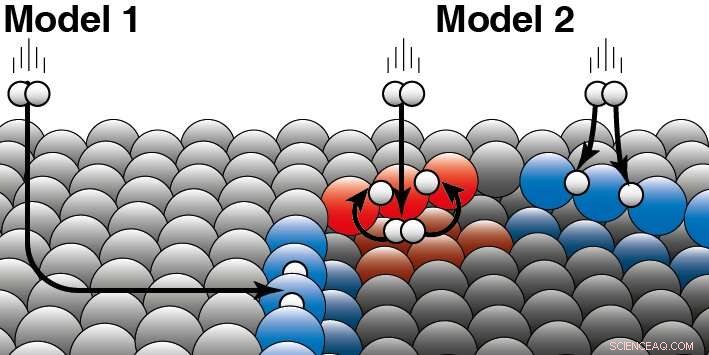
Un catalizzatore accelera una reazione chimica senza consumarsi. Nella catalisi eterogenea, il catalizzatore è solitamente un solido e i reagenti un gas o un liquido. Juurlink spiega la differenza tra i due modelli:"I due modelli si basano su diversi presupposti su come l'energia cinetica della molecola di idrogeno "si disperda" durante la collisione con la superficie del platino." Per chiarire questo, fa un esempio:'Se un cane è in una buca di ghiaccio, potrebbe essere finito lì in due modi. O è scivolato sul ghiaccio di lato ed è caduto nel buco del ghiaccio, oppure è saltato direttamente nel buco di ghiaccio di lato». La loro ricerca ora mostra che le molecole di idrogeno reagiscono principalmente direttamente dalla fase gassosa sul bordo del gradino del platino (modello 2). Modello 1, ciò presuppone che la maggior parte delle molecole finisca ai bordi "pattinando" sulla superficie piatta di platino e solo allora reagisca non è quindi corretto. I ricercatori hanno visto differenze tra i due diversi tipi di bordi (rosso e blu) che si verificano naturalmente sui catalizzatori al platino. L'idrogeno può atterrare sulla parte superiore o inferiore di tale bordo. Per entrambi i tipi di bordi gradino, i ricercatori sono in grado di decidere quale parte reagisce direttamente sul lato superiore (come illustrato in blu) o prima atterra sul lato inferiore (come in rosso). Credito:Università di Leiden
La ricerca è stata condotta in ultra-alto vuoto e fornisce importanti spunti. "Ora sappiamo meglio come calcolare la velocità delle reazioni chimiche:uno dei modelli non contribuisce in modo significativo, " dice Juurlink. "Inoltre, ora sappiamo che queste superfici curve di cristallo offrono un unico, nuova opportunità per imparare come avvengono effettivamente le reazioni chimiche sulle superfici. Sicuramente faremo più ricerche su questo".
Quasi tutti i principali processi industriali chimici utilizzano la catalisi eterogenea. I catalizzatori a volte sono costosi e rari, come il platino, un catalizzatore comune che si trova nelle celle a combustibile e nei sistemi di scarico delle auto. "La cosa insolita è che di solito non sappiamo nemmeno come e perché tali catalizzatori accelerano le reazioni chimiche, " afferma Juurlink. Una migliore comprensione di ciò come e perché contribuirà a rendere l'industria chimica più sostenibile. "Sulla base di una migliore comprensione di ciò che sta accadendo a livello atomico, possiamo sviluppare nuovi catalizzatori, " dice Juurlink. "Catalizzatori che causano una minore perdita di energia e dipendono meno da materiali costosi e rari".