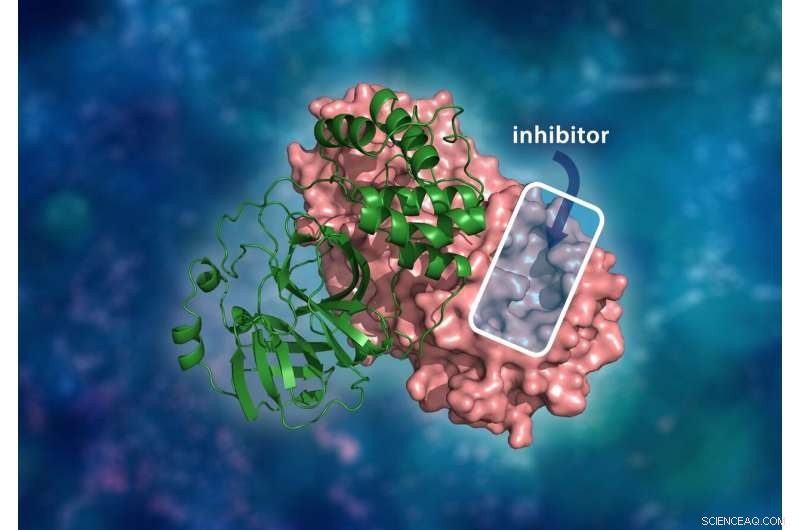
La struttura tridimensionale della proteasi principale SARS-CoV-2. Il complesso del dimero molecolare è costituito da un singolo monomero (verde) legato a un altro monomero (rosa) dove un inibitore del farmaco si legherebbe a una cavità del sito catalitico per impedire la replicazione del virus. Credito:ORNL/Andrey Kovalevsky, Jill Hemman
Mentre il nuovo coronavirus continua a diffondersi, i ricercatori stanno cercando nuovi modi per fermarlo. Ma per due scienziati, guardare al futuro significa trarre ispirazione dal passato.
Nel gennaio del 2020, Andrey Kovalevsky e Daniel Kneller, ricercatori dell'Oak Ridge National Laboratory (ORNL) del Department of Energy (DOE), si stavano preparando a utilizzare i neutroni per studiare la relazione tra una certa proteasi dell'HIV, un enzima proteico che consente al virus di replicarsi all'interno del corpo umano, e una classe di farmaci antiretrovirali noti come inibitori della proteasi dell'HIV. Alcuni tipi di HIV sviluppano resistenza a questi farmaci. L'obiettivo dei ricercatori era quello di ottenere una migliore comprensione di come funzionano le variazioni della proteasi, per aiutare lo sviluppo di trattamenti all'avanguardia per sopraffare anche i ceppi di HIV più resistenti.
Quando la squadra ha iniziato a lavorare, poco lo sapevano, coincidentalmente, i loro sforzi per studiare l'HIV li metterebbero rapidamente su un nuovo percorso per affrontare il COVID-19, la pandemia che ora ha il mondo in pugno.
Come risulta, l'attività enzimatica della proteasi che consente all'HIV di riprodursi - lo stesso meccanismo che il team di Kovalevsky si stava attrezzando per indagare con i neutroni - è lo stesso meccanismo di replicazione impiegato da SARS-CoV-2, il virus che causa la malattia COVID-19.
Ora, il team ha spostato il focus dell'approccio sperimentale che intendevano utilizzare per studiare l'HIV per combattere la nuova minaccia globale.
Gli studi sull'HIV ruotano verso il nuovo coronavirus
Kovalevsky studia l'HIV da 15 anni. Come cristallografo di neutroni, studia piccoli campioni cristallizzati di materia biologica bombardandoli con neutroni. La tecnica della diffusione dei neutroni è molto efficace nel rivelare come è organizzata la struttura atomica di un campione e come si comportano i suoi atomi. A seconda dello scopo, le intuizioni raccolte possono offrire indicazioni su come migliorare o addirittura sopprimere determinate proprietà di un materiale biologico.
I neutroni sono uno strumento ideale per studiare strutture e comportamenti biologici a causa della loro acuta sensibilità agli elementi leggeri come l'idrogeno e la loro capacità di sondare tali materiali senza danneggiarli.
Nel 2019, Kovalevsky ha deciso di studiare l'HIV in un modo che non era mai stato fatto prima. L'uso della diffusione anelastica di neutroni gli consentirebbe di raccogliere dati sulla dinamica, o i movimenti, di una proteasi dell'HIV, che si aggiungerebbe ai dati sulla diffrazione dei neutroni che raccoglieva da anni. Avere sia le informazioni strutturali che comportamentali, o dinamiche, fornirebbe un quadro più completo di come funziona il virus e, a sua volta, potrebbe portare a nuovi progressi nei trattamenti.
Dopo aver utilizzato lo spettrometro VISION presso la Spallation Neutron Source (SNS) dell'ORNL, uno strumento di diffusione di neutroni che rivela i movimenti degli atomi in base alle loro vibrazioni, Kovalevsky si è reso conto di aver bisogno di aiuto nell'analisi dei dati.
"Daniel apporta esperienza nella ricerca sulla proteasi virale, " ha spiegato Kovalevsky sul reclutamento di Kneller. "Sa come lavorare con le proteine in laboratorio. Conosce tutte le tecniche di laboratorio in termini di produzione di proteine, purificazione, cristallizzazione, raccolta di dati cristallografici, e analisi per ottenere approfondimenti sulla progettazione dei farmaci".
Ci sono voluti circa 8 mesi per assumere Daniel dopo un'ampia ricerca, dice Kovalevskij. Kneller, specializzato nello studio della proteasi dell'HIV utilizzando la cristallografia, si è unito al team di Kovalevsky nel gennaio del 2020 per aiutare con il lavoro sperimentale e computazionale sulla proteasi dell'HIV.
Ma proprio mentre la squadra era pronta a tuffarsi, Il COVID-19 era diventato globale, e la ricerca ha avuto un duro colpo.

Il ricercatore post-dottorato Daniel Kneller sta utilizzando il Centro per la biologia strutturale e molecolare dell'ORNL per sintetizzare le proteine cristallizzate correlate al COVID-19 e prepararle per gli studi sulla diffusione dei neutroni presso la Spallation Neutron Source e l'High Flux Isotope Reactor. Credito:ORNL/Carlos Jones
Cambio di marcia, ottenere i primi risultati
A marzo, lo staff di Neutron Sciences di ORNL ha sviluppato un piano per studiare i componenti chiave di COVID-19 assemblando gruppi di ricerca e ridefinendo le priorità dei programmi operativi degli strumenti essenziali presso le due strutture di diffusione di neutroni presso l'ORNL, SNS e il reattore isotopico ad alto flusso (HFIR).
Avendo già posto le basi per lo studio della proteasi, Kovalevsky e Kneller sono passati prontamente dall'HIV al nuovo coronavirus. Nello specifico, sono attualmente focalizzati sulla principale proteasi di SARS-CoV-2, il virus che causa la malattia COVID-19.
"La proteasi SARS-CoV-2 è un enzima che taglia le proteine che consentono al virus di riprodursi. Comprendere come viene assemblata la proteasi e come funziona è un primo passo fondamentale per trovare inibitori di farmaci efficaci per bloccare il meccanismo di replicazione del virus, " ha detto Kovalevsky. "Simile alla proteasi dell'HIV, la principale proteasi del virus SARS-CoV-2 è uno dei bersagli farmacologici più interessanti in questo momento per la progettazione di inibitori specifici".
Come con il piano originale del lavoro sull'HIV, il team si sta preparando a utilizzare gli strumenti di SNS e HFIR per ottenere informazioni fondamentali su come sono organizzati gli atomi nella proteasi. Utilizzando gli strumenti MaNDi e IMAGINE, i ricercatori saranno in grado di mettere insieme la struttura atomica della proteasi utilizzando neutroni per tracciare gli atomi di idrogeno all'interno dei campioni di proteine cristallizzate.
Ma prima, devono ottenere cristalli di alta qualità sufficientemente grandi per esperimenti sui neutroni. È qui che la squadra ha fatto passi da gigante all'inizio.
La qualità dei cristalli è determinata innanzitutto da quanto bene si diffrange, o disperso, Raggi X. Tipicamente, questo processo viene condotto in un impianto di sincrotrone, dove i cristalli potrebbero essere congelati a circa 100 K (o circa -280°F).
Il team ha utilizzato il laboratorio di cristallizzazione e caratterizzazione delle proteine presso SNS per far crescere cristalli di proteasi SARS-CoV-2, che ha richiesto circa una settimana a 10 giorni. Per analizzare la qualità dei cristalli, hanno usato la macchina a raggi X locale, un Rigaku HighFlux HomeLab, che ha fornito diversi risultati chiave.
Primo, gli esperimenti ai raggi X hanno confermato che i cristalli erano di alta qualità e che il metodo utilizzato per farli crescere potrebbe produrre cristalli più grandi adatti per esperimenti sui neutroni. Secondo, avere una macchina locale ha permesso loro di raccogliere misurazioni a raggi X a temperatura ambiente, intorno ai 70°F.
Le misurazioni della temperatura ambiente hanno permesso loro di osservare la plasticità, o flessibilità, della struttura proteasica, fornendo informazioni distinguibili su come si comporta la struttura in condizioni vicine all'ambiente fisiologico del virus. Tali dati non avrebbero potuto essere ottenuti utilizzando campioni congelati.
"Questa è una pietra miliare importante nel nostro sforzo per fare la diffrazione di neutroni. L'investimento in una macchina a raggi X locale è stato ripagato abbastanza bene, " disse Kneller. "In un caso, lunedì abbiamo coltivato cristalli e martedì abbiamo raccolto dati su di essi. Altrimenti, per ottenere quell'informazione dovresti inviare i tuoi cristalli a un sincrotrone, che potrebbe richiedere giorni o settimane."
"E adesso, a causa della pandemia, non puoi andare al sincrotrone, " ha aggiunto Kovalevsky. "E per analizzare i cristalli a temperatura ambiente, devi esserci".
"Le informazioni che abbiamo appreso dalla struttura a temperatura ambiente hanno la capacità di influenzare immediatamente le direzioni computazionali utilizzate dai ricercatori. Abbiamo trovato alcune differenze tra la nostra struttura quasi fisiologica a temperatura ambiente e le strutture congelate dei sincrotroni, che può essere importante per il lavoro di calcolo, come gli studi sull'attracco di piccole molecole in corso sul vertice di supercomputer dell'ORNL, " disse Kneller.

Vista microscopica dei cristalli di proteasi SARS-CoV-2 cresciuti nel laboratorio di cristallizzazione e caratterizzazione delle proteine dell'ORNL. Una volta che i cristalli raggiungono una certa dimensione e forma, saranno utilizzati in esperimenti di diffusione di neutroni per determinare come è strutturata la proteasi principale SARS-CoV-2 e come si comporta. Attestazione:ORNL/Daniel Kneller
"Finora, abbiamo avuto molto successo nei nostri primi studi su COVID-19. Abbiamo già inviato un manoscritto per la pubblicazione sui nostri risultati strutturali, in cui abbiamo essenzialmente condotto due mesi di ricerca che normalmente avrebbero richiesto un anno".
Ad aiutare Kovalevsky e Kneller nell'analisi dei dati e della struttura dei cristalli proteici c'era Leighton Coates, uno scienziato dello strumento sul diffrattometro SNS MaNDi che è anche membro del team cristallografico che studia la proteasi SARS-CoV-2.
I dati generati nei prossimi mesi saranno condivisi con altri laboratori nazionali, università, e la più ampia comunità scientifica per costruire modelli più accurati per simulazioni computazionali utilizzate per identificare potenziali farmaci candidati per fermare il virus.
"La comunità scientifica ha risposto rapidamente alla pandemia di COVID-19. Siamo fortunati di poter dare il nostro contributo sfruttando anni di esperienza nello studio dell'HIV per costruire una migliore comprensione di come si replica il nuovo coronavirus e come possiamo combatterlo da inibendo la sua proteasi essenziale, " disse Kovalevskij.
Ricercare la resistenza all'HIV
Prima che la pandemia rivolgesse la loro attenzione e i loro sforzi alla ricerca su SARS-CoV-2, Kovalevsky e Kneller avevano un piano chiaro per attaccare l'HIV.
Trentanove milioni di persone nel mondo sono infettate dall'HIV. Fornire a queste persone migliori opzioni di trattamento non solo migliorerebbe la loro qualità di vita, ma impedirebbe anche che questa malattia si diffonda ulteriormente.
La proteasi dell'HIV agisce tagliando in modo innocuo, o non funzionale, filamenti di proteine in proteine più piccole, trasformandoli in proteine virali funzionali che consentono al virus di assemblarsi e continuare a infettare cellule umane sane. Generalmente, Gli inibitori della proteasi dell'HIV sono abbastanza efficaci nel bloccare la proteasi durante la replicazione dell'HIV, ma alcune varianti della proteasi hanno sviluppato la capacità di resistere agli inibitori dei farmaci.
"Se possiamo saperne di più sui meccanismi molecolari che rendono le varianti della proteasi dell'HIV resistenti ai farmaci, possiamo progettare farmaci meglio attrezzati per superare in astuzia le sue difese, " disse Kneller.
Nello specifico, Kneller e Kovalevsky volevano esplorare PRS-17, una variante unica della proteasi dell'HIV che è 10, 000 volte meno probabilità rispetto ad altre varianti non resistenti di essere inibite dai più efficaci inibitori clinici della proteasi dell'HIV attualmente disponibili. Kovalevsky ha spiegato che mentre i programmi di trattamento dell'HIV hanno fatto molta strada dall'inizio della pandemia di HIV negli anni '80, varianti mutanti come PRS-17, derivante da un trattamento prolungato, potrebbe compromettere anni di innovazione e progresso farmaceutico e portare a terapie antivirali fallite.
"La resistenza ai farmaci è ora il problema più grande per i pazienti affetti da HIV. Con un trattamento adeguato, i pazienti possono vivere una vita lunga e felice con livelli non rilevabili di HIV nel loro sistema. Non svilupperanno l'AIDS né diffonderanno l'HIV ad altri. Ma PRS-17 e altre varianti di proteasi dell'HIV resistenti ai farmaci rendono difficile per i medici combattere l'HIV nei loro pazienti, " disse Kovalevskij.
Capire esattamente come PRS-17 neutralizza l'efficacia degli inibitori della proteasi dell'HIV è difficile, dicono i ricercatori. Le proteine costituenti i virus sono sistemi complessi, e PRS-17 ha la capacità di impiegare diversi meccanismi per proteggersi dai farmaci antiretrovirali.
"Capire come PRS-17 resiste agli inibitori della proteasi dell'HIV è una sfida, ma uno che dobbiamo assolutamente superare. PRS-17 è un isolato clinico, il che significa che proviene da un paziente reale che lotta per combattere questa malattia, " ha spiegato Kneller. "Saperne di più potrebbe salvare la vita di molti pazienti, perché la conoscenza che otteniamo usando i neutroni su PRS-17 sarà trasferibile ad altre varianti di proteasi simili estremamente resistenti ai farmaci".
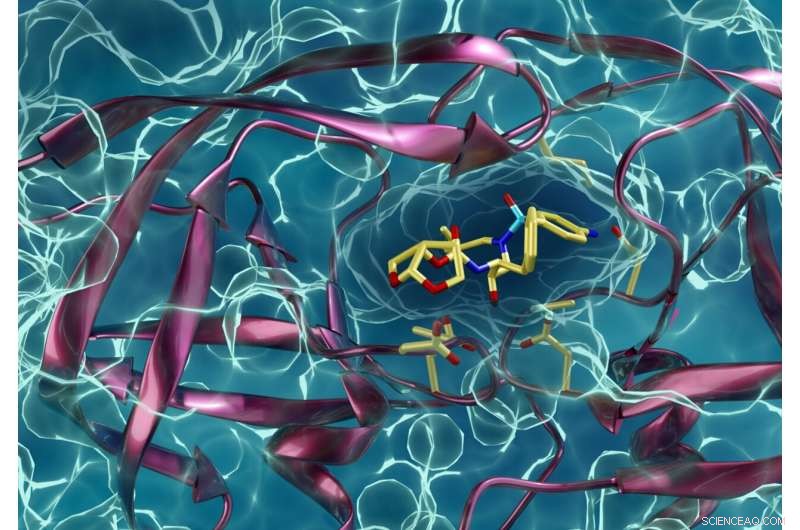
Un tipo di proteasi dell'HIV resistente ai farmaci che interagisce con un inibitore della proteasi dell'HIV. Kneller e Kovalevsky sperano che le stesse tecniche che hanno usato per saperne di più sull'HIV aiuteranno anche i colleghi ricercatori a combattere il COVID-19. Attestazione:ORNL/Jill Hemman
Il team intendeva creare una mappa della proteasi PRS-17 per comprendere meglio i meccanismi molecolari alla base della sua resistenza ai farmaci. Ciò ha comportato l'utilizzo degli strumenti MaNDi e VISION presso SNS e lo strumento IMAGINE presso HFIR.
"Era più o meno lo stesso approccio che stiamo provando ora con COVID-19, " disse Kovalevskij.
Con ManDi e IMAGINE, Kneller e Kovalevsky stavano pianificando di sondare campioni cristallizzati di proteasi PRS-17 per generare dati dettagliati sulla sua struttura atomica statica. L'utilizzo di VISION consentirebbe loro di sondare campioni in polvere di proteasi PRS-17 per fornire informazioni sulle sue proprietà dinamiche misurando le vibrazioni molecolari.
I neutroni sono particolarmente adatti per studiare componenti di virus come l'HIV (o SARS-CoV-2) a causa della loro sensibilità all'idrogeno, un componente importante di tutte le proteine. Con la cristallografia a neutroni, il team è riuscito a localizzare con precisione ogni atomo di idrogeno all'interno della proteasi di PRS-17, fornendo loro informazioni senza precedenti su come funziona la proteina e quali interazioni subisce con un inibitore della proteasi.
"Usa la cristallografia di neutroni a MaNDi e IMAGINE per localizzare gli atomi di idrogeno nei cristalli di proteasi PRS-17, ci consentirebbe di costruire un profilo completo della sua struttura statica, " ha detto Kneller. "Con VISION, rintracceremmo anche gli atomi di idrogeno, ma useremmo campioni in polvere di proteasi PRS-17 che sono stati reidratati per imitare le condizioni affollate di una particella virale dell'HIV. Ciò ci consentirebbe di vedere le sue proprietà dinamiche e saperne di più su come potrebbe muoversi quando funziona all'interno di una particella virale".
Kneller ha spiegato che ottenere informazioni sulle proprietà statiche e dinamiche del PRS-17 è importante per sviluppare una comprensione completa della resistenza di questo virus ai farmaci antiretrovirali.
"Se rintracciassi la tua posizione solo una volta al giorno a mezzanotte, Penso che passi tutto il tuo tempo a casa. Ma veramente, ti muovi un po' durante la giornata. Ecco perché è importante raccogliere misurazioni sia statiche che dinamiche del nostro campione. Ci permette di costruire un quadro più completo del comportamento della proteasi, " disse Kneller.
"Senza cristallografia di neutroni, i ricercatori devono fare ipotesi plausibili su dove si trovano gli atomi di idrogeno in una proteina ogni volta che cercano di capire come la proteina fa il suo lavoro, " ha aggiunto Kneller. "Questi tipi di esperimenti che Andrey ha fatto in precedenza sono stati effettivamente in grado di confermare la posizione di questi atomi di idrogeno nelle varianti di proteasi dell'HIV non resistenti, ma mai in una variante di proteasi estremamente resistente ai farmaci. Ciò significa che saremmo in grado di produrre dati davvero unici e nuovi su questa proteasi".
Kneller e Kovalevsky sperano un giorno di generare dati attraverso i loro esperimenti che diventeranno una risorsa inestimabile per i ricercatori che cercano di combattere i ceppi di HIV resistenti ai farmaci.
"È un lavoro di squadra. Chimici, biologi, e i professionisti dell'industria farmaceutica devono lavorare insieme per combattere le malattie, " disse Kneller. "Insieme, possiamo sviluppare trattamenti efficaci per i ceppi di HIV resistenti ai farmaci".
La ricerca è stata supportata dal DOE Office of Science attraverso il National Virtual Biotechnology Laboratory, un consorzio di laboratori nazionali DOE focalizzato sulla risposta a COVID-19, con i finanziamenti previsti dal Coronavirus CARES Act.