Credito:Angewandte Chemie
Il nostro sistema immunitario dovrebbe essere in grado di riconoscere e uccidere le cellule tumorali. Però, molti tumori ingannano il sistema immunitario. Per esempio, inducono i cosiddetti checkpoint immunitari delle cellule T a spegnere le risposte immunitarie. Nel diario Angewandte Chemie , gli scienziati hanno ora introdotto un nuovo approccio per il trattamento immunologico dei tumori. Il loro metodo si basa sul blocco specifico di un checkpoint immunitario da parte di un peptide "immagine speculare" stabile.
I linfociti T hanno una varietà di checkpoint immunitari sulla loro superficie, alcuni che stimolano il sistema immunitario e altri che sopprimono le reazioni immunitarie quando "scoprono" ligandi adatti sulle superfici delle cellule "controllate". Uno di questi checkpoint immunitario è la proteina 1 della morte cellulare programmata (PD-1). Se il ligando PD-L1 è legato a PD-1, la risposta immunitaria è inibita per prevenire l'attacco alle cellule sane prodotte dall'organismo. Sfortunatamente, molti tumori si "mimetizza" con un numero particolarmente elevato di PD-L1, che li protegge. Il blocco dell'interazione tra PD-1 e PD-L1 può normalizzare l'immunità al cancro nel microambiente intorno ai tumori. Però, i precedenti approcci terapeutici hanno avuto solo un successo limitato, e i tumori spesso sviluppavano resistenza.
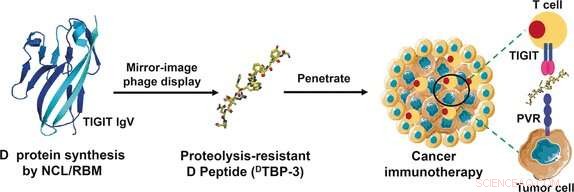
Un checkpoint immunitario appena scoperto noto come TIGIT potrebbe fornire un punto di attacco alternativo. TIGIT reagisce a un ligando denominato PVR con un segnale immunosoppressivo. Un team di ricercatori della Zhengzhou University di Zhengzhou, Università Tsinghua di Pechino, e l'Università Sun Yat-sen di Shenzhen, guidato da Yanfeng Gao e Lei Liu ha utilizzato i dati di espressione dell'RNA dal Cancer Genome Atlas e il set di dati Gene Expression Omnibus per scoprire che TIGIT è molto più comune del PD-1 in molti tumori, compresi quelli resistenti alla terapia anti-PD-1.
I ricercatori volevano utilizzare un peptide come nuovo farmaco perché queste molecole penetrano più profondamente nei tessuti con affinità e specificità uguali a quelle degli anticorpi. Causano significativamente meno effetti collaterali immunologici indesiderati e sono più facili da produrre. Il loro svantaggio è che vengono rapidamente scomposti dalle proteasi nel corpo. Per questa ragione, i ricercatori hanno deciso di utilizzare peptidi "immagine speculare", stabili nei confronti delle proteasi. Gli amminoacidi possono esistere nella configurazione L naturale, o la sua immagine speculare, la configurazione D sintetica. I peptidi D prodotti dagli amminoacidi D sono significativamente più longevi dei peptidi L.
Per trovare un peptide adatto, i ricercatori hanno utilizzato la tecnica di visualizzazione dei fagi a immagine speculare. In questo metodo, sulla superficie dei fagi (virus che attaccano i batteri) si presenta un numero molto elevato di diversi peptidi prodotti biotecnologicamente. Quelli che si legano alla molecola bersaglio desiderata vengono quindi selezionati e moltiplicati nei batteri. Quindi passano attraverso ulteriori cicli di selezione fino a quando rimangono solo peptidi molto fortemente leganti. Inizialmente, I peptidi L sono presentati in un display fagico a immagine speculare. Però, quelli selezionati si legano all'immagine speculare della molecola bersaglio. Per questo, i ricercatori hanno sintetizzato una porzione di TIGIT nella configurazione D. Come ultimo passo, hanno prodotto la versione D speculare del peptide L più forte, che si adattava perfettamente all'interfaccia di legame chiave della proteina TIGIT/PVR.
Il D-peptide sviluppato da questa tecnica, conosciuto come
D
-TBP-3, blocca efficacemente l'interazione di TIGIT con PVR, è stabile nei confronti delle proteasi, e inibisce la crescita e la metastasi di modelli di tumore resistenti all'anti-PD-1.