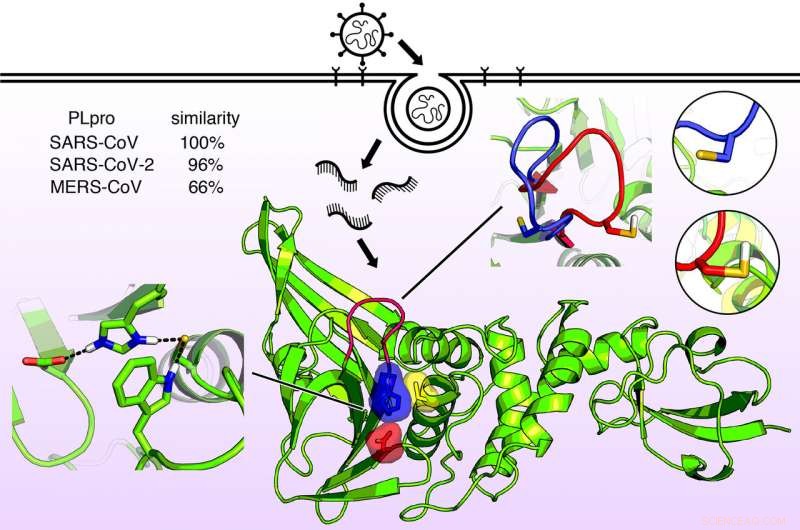
Struttura molecolare dell'enzima simile alla papaina noto come PLPro. Questo enzima permette ai virus che causano la SARS, MER, e COVID-19 per infettare le cellule e replicare e sopprimere la funzione immunitaria dell'ospite. Ora che la struttura dell'enzima è nota in dettaglio, possono essere progettati nuovi farmaci antivirali. Credito:Jack Henderson, Facoltà di Farmacia dell'Università del Maryland
Il COVID-19 è causato da un virus noto come SARS-CoV-2, che è simile nella struttura ad altri due virus che hanno causato recenti epidemie:SARS-CoV, che ha causato un focolaio di SARS nel 2003, e MERS-CoV, la causa di un focolaio di sindrome respiratoria mediorientale nel 2012.
Nel Giornale di Fisica Chimica , scienziati della School of Pharmacy dell'Università del Maryland riportano indagini a livello molecolare su questi tre virus, fornendo un possibile percorso verso nuovi farmaci antivirali per combattere tutte e tre le malattie. In questo momento, non esistono cure o farmaci efficaci per nessuna di queste malattie da coronavirus.
I ricercatori hanno esaminato una proteina virale che svolge un ruolo chiave nella capacità del virus di replicarsi una volta all'interno del corpo. Questa proteina svolge anche un ruolo nella sconfitta del sistema immunitario dell'ospite, quindi fornisce un obiettivo particolarmente attraente per potenziali trattamenti farmacologici.
La proteina, un enzima noto come proteasi simile alla papaina, PLPro, è quasi identico in SARS-CoV-2 e SARS-CoV ma è leggermente diverso in MERS-CoV. Molto recentemente, la prima radiografia strutturale di questo enzima ha rivelato una forma nel dominio catalitico un po' come una mano con un "pollice, " "palma, " e "dita".
Il pollice e il palmo si uniscono per formare un sito di legame, dove una molecola di farmaco potrebbe potenzialmente essere catturata. Le dita si piegano su questa regione e forniscono l'integrità strutturale essenziale per l'attività PLPro.
I ricercatori hanno scoperto che piccoli cambiamenti nel pH potrebbero cambiare la forma di questo enzima attraverso un processo noto come protonazione, dove gli ioni idrogeno si legano a determinate unità di amminoacidi nella proteina.
"Il cambio di stato di protonazione è un importante meccanismo di trasduzione dell'energia, " ha detto l'autrice Jana Shen.
Il coautore Jack Henderson ha dichiarato:"La proteina spike del coronavirus, Per esempio, fa uso di interruttori di stato di protonazione per indurre grandi cambiamenti conformazionali necessari per la fusione della membrana".
La fusione della membrana è il primo passo nell'infezione. Un virus si attacca alla membrana esterna di una cellula, facendosi strada all'interno dove può iniziare a formare copie di se stesso che si diffondono in tutto il corpo.
Un'altra caratteristica chiave del sito di legame PLpro è una stringa di unità di amminoacidi chiamata loop BL2. I ricercatori hanno scoperto che questo ciclo può aprirsi o chiudersi nei virus SARS quando un particolare amminoacido sul ciclo viene protonato o deprotonato. Nel virus MERS, però, il ciclo è flessibile anche senza tale amminoacido.
Questa caratteristica suggerisce che un potenziale farmaco potrebbe colpire il ciclo BL2, facendolo chiudere e legarsi strettamente a un inibitore virale.
"Il nostro lavoro fornisce un punto di partenza per ulteriori indagini meccanicistiche utilizzando approcci di livello superiore, " ha detto Shen.