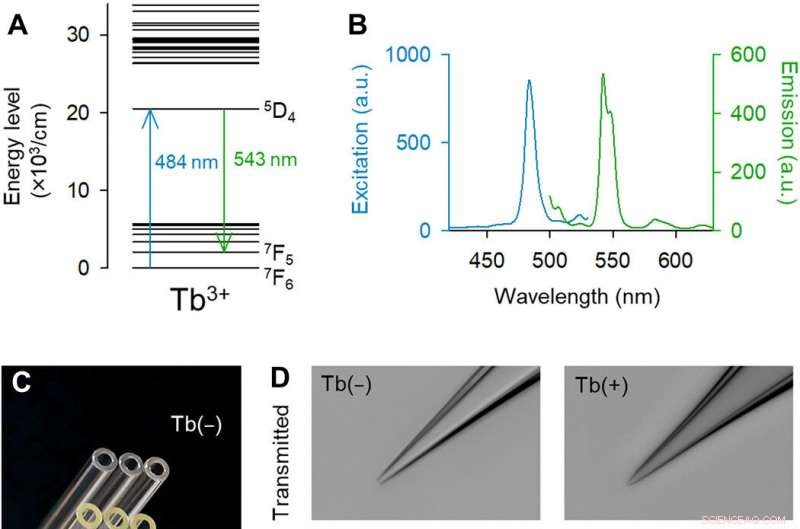
Le pipette drogate con Tb3+ emettono fluorescenza verde. (A) Diagramma del livello energetico parziale di Tb3+ [estratto parzialmente da (14)]. (B) Spettri di eccitazione (blu) ed emissione (verde) di 3,1 moli % di vetro drogato con Tb3+. (C) Fotografia macroscopica a colori dei capillari di vetro di controllo (in alto) e Tb3+ (in basso). Credito fotografico:Yuji Ikegaya, L'Università di Tokio. (D) Immagini monocromatiche in campo chiaro (in alto) e in fluorescenza (in basso) delle punte delle pipette di vetro di controllo (a sinistra) e Tb3 + (a destra) (eccitazione laser a 488 nm a 25 mW). Pipette in vetro drogato con Tb3+ emettevano fluorescenza verde. Credito fotografico:Kazuki Okamoto, L'Università di Tokyo e l'Università Juntendo. (E) Immagine al microscopio elettronico a scansione della punta di una pipetta drogata con Tb3+. Credito fotografico:Hiroyuki Hioki, Università Juntendo. (F) Resistenze delle pipette di controllo (nero) e pipette drogate con Tb3+ (verde). I rettangoli mostrano le mediane e il 25° e 75° percentile, e i baffi mostrano il 10° e il 90° percentile. n =48 pipette, Test t di studente. (G) Lo stesso di (F) ma per le capacità delle pipette. n =da 7 a 8 pipette, Test t di studente. Credito:progressi scientifici, doi:10.1126/sciadv.abd2529
Le indagini e le manipolazioni ottiche spesso costituiscono il nucleo degli esperimenti biologici. In un nuovo rapporto ora pubblicato in Progressi scientifici , Kazuki Okamato e un team di scienziati in scienze farmaceutiche, neuroscienza, medicinale, fisica e intelligenza artificiale all'Università di Tokyo, Giappone, ha introdotto un nuovo materiale in vetro borosilicato contenente uno ione di terre rare terbio (III) (Tb 3+ ). Il materiale emetteva fluorescenza verde all'eccitazione della luce blu, molto simile alla proteina fluorescente verde (GFP) con ampia compatibilità tra ambienti di ricerca biologica. Utilizzando micropipette in vetro drogato con terbio, Okamato et al. celle marcate con GFP mirate per l'elettroporazione a cella singola, analisi del trascrittoma a cellula singola ed esperimenti di registrazione patch-clamp sotto controllo microscopico a fluorescenza in tempo reale. Il vetro ha anche mostrato la potenziale generazione di terza armonica dopo l'eccitazione del laser a infrarossi, utile per il targeting ottico online di neuroni marcati con fluorescenza nella neocorteccia in vivo. In questo modo, il vetro drogato con terbio ha semplificato le procedure multiple negli esperimenti biologici con applicazioni più ampie nella ricerca biomedica.
Conduzione di indagini ottiche in vivo
Le indagini ottiche e le manipolazioni cellulari all'interno dei tessuti viventi sono molto diffuse nella ricerca biologica con la capacità di rivelare diverse proprietà nelle cellule e durante la comunicazione intracellulare. Sebbene l'etichettatura genetica abbia consentito l'identificazione di cellule che esprimono proteine fluorescenti, rimane difficile accedere alle cellule marcate con fluorescenza utilizzando pipette di vetro poiché il vetro non è fluorescente nell'intervallo visibile. Per risolvere questi problemi tecnici, Okamato et al. ha introdotto una nuova composizione di vetro borosilicato. Gli ioni delle terre rare hanno mostrato un'emissione di fluorescenza unica con picchi acuti nello spettro della luce visibile. Il team si è concentrato sul terbio (III) (Tb 3+ ), che hanno strutture di livello energetico complesse e teoricamente dovrebbero emettere fluorescenza verde. La lunghezza d'onda di eccitazione era vicina alla massima visibilità per gli occhi umani e vicina a quella della proteina fluorescente verde. Di conseguenza, pipette fatte di vetri drogati con terbio erano utili per la fluorescenza mirata, manipolazione unicellulare nelle scienze della vita.
Elettroporazione a singola cellula mirata con fluorescenza e analisi del trascrittoma utilizzando pipette drogate con Tb3+. (A) Elettroporazione del gene a cellula singola utilizzando pipette drogate con Tb3+. Una pipetta drogata con Tb3+ contenente un vettore pCMV-tdTomato è stata attaccata a una cellula piramidale dell'ippocampo EGFP-positiva in una coltura organotipica (in alto; DiV 16), e sono stati applicati impulsi elettrici. Dopo 48 ore, il neurone bersaglio ha espresso tdTomato (in basso). Barra della scala, 20 micron. (B) Patch-seq utilizzando pipette drogate con Tb3+. Una pipetta drogata con Tb3+ è stata attaccata a un interneurone GABAergico GFP-positivo in una fetta corticale acuta di un topo transgenico PV-GFP, e l'RNA è stato estratto applicando l'aspirazione (in alto). Barra della scala, 50 micron. Trascrizioni per milione (TPM) di cellule GFP-positive e GFP-negative (in basso). I punti grigi indicano tutte le trascrizioni geniche rilevate. I punti rossi sono trascrizioni di geni unici rappresentativi, Pvalb e Gad2 (GAD65) per cellule GFP-positive rispetto a Mef2c e Slc17a7 (VGLUT1) per cellule non-GFP-positive. Credito fotografico:Kazuki Okamoto, L'Università di Tokyo e l'Università Juntendo. Credito:progressi scientifici, doi:10.1126/sciadv.abd2529 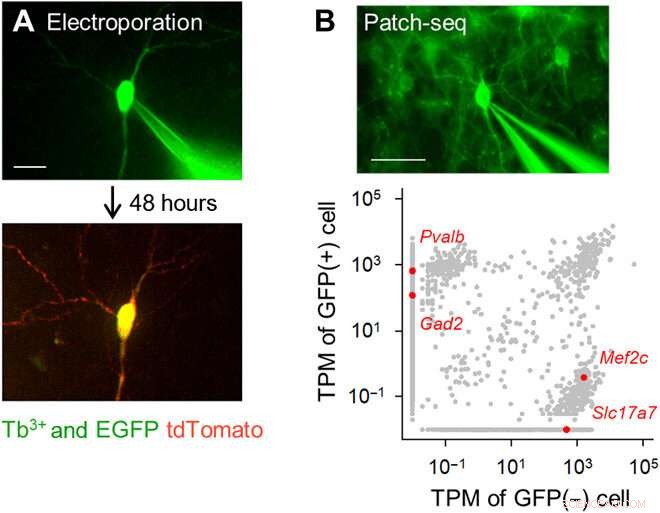
Il team ha sviluppato il vetro borosilicato utilizzando il 3,1 moli percento (moli %) di ossido di terbio (Tb 2 oh 3 ). Il terbio (Tb 3+ )-vetro drogato emetteva fluorescenza verde visibile ad occhio nudo, anche sotto la luce della stanza. il Tb 3+ -il vetro drogato aveva un picco di assorbimento a una lunghezza d'onda di 484 nm, che non è stato osservato nel normale vetro borosilicato senza terbio. Gli scienziati hanno prodotto capillari e pipette di vetro in cui il vetro stampato ha continuato a emettere fluorescenza verde. Utilizzando la microscopia elettronica a scansione, il team ha controllato i puntali delle pipette per eventuali aberrazioni che potrebbero influenzare la qualità delle registrazioni elettrofisiologiche. Okamato et al. successivamente ha utilizzato le nuove micropipette per condurre l'elettroporazione di una singola cellula di una proteina fluorescente rossa (tdTomato) nei neuroni nelle strutture di sezioni organotipiche dell'ippocampo di ratto. Hanno visto le pipette contenenti il vettore colorante rosso e le cellule piramidali che sono state etichettate in minima parte con GFP potenziato, utilizzando lo stesso apparato ottico. Gli scienziati hanno attaccato i puntali delle pipette alle cellule e hanno applicato impulsi elettrici per l'elettroporazione per facilitare l'espressione del colorante rosso dopo 48 ore. Successivamente, il team ha eseguito il sequenziamento dell'RNA unicellulare con le pipette in sezioni acute della corteccia motoria primaria di topi transgenici.
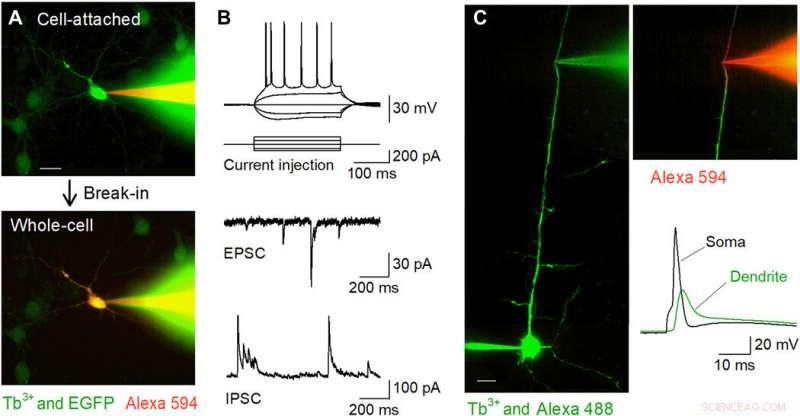
Registrazioni di patch-clamp mirate con fluorescenza in vitro utilizzando pipette drogate con Tb3+. (A) Immagini confocali del disco Nipkow durante la registrazione del patch-clamp da un neurone ippocampale coltivato positivo EGFP (verde) utilizzando una pipetta drogata con Tb3 + (verde) riempita con Alexa Fluor 594 (rosso). La cella è stata intrappolata in modalità cella collegata (in alto) e quindi trattenuta in modalità cella intera (in basso). Barra della scala, 20 micron. (B) Forme d'onda rappresentative dei potenziali d'azione indotti dall'iniezione di corrente (in alto), EPSC spontanei (al centro), e IPSC spontanee (in basso) registrate da cellule piramidali CA1 in fettine di ippocampo acuto utilizzando pipette drogate con Tb3+. (C) Registrazioni mirate di patch-clamp dendritiche utilizzando pipette drogate con Tb3+. Una cellula piramidale di livello 5 è stata caricata intracellularmente con Alexa Fluor 488 tramite registrazione somatica di cellule intere, e il suo dendrite apicale è stato preso di mira per un'ulteriore registrazione di cellule intere utilizzando una pipetta drogata con Tb3+ sotto visualizzazione confocale del disco Nipkow. Barra della scala, 20 micron. Dopo l'irruzione, il dendrite è stato visualizzato da Alexa Fluor 594 caricato a livello intracellulare tramite la pipetta drogata con Tb3+ (in alto a destra). Un potenziale d'azione retropropagante è stato registrato dalla pipetta drogata con Tb3+ a seguito di un potenziale d'azione evocato nel soma (in basso a destra). Credito fotografico:Kazuki Okamoto, L'Università di Tokyo e l'Università Juntendo. Credito:progressi scientifici, doi:10.1126/sciadv.abd2529
Utilizzo delle nuove micropipette per registrazioni patch clamp in vitro
I ricercatori hanno poi condotto registrazioni patch-clamp da colture primarie di neuroni ippocampali che erano scarsamente etichettati con GFP utilizzando una pipetta drogata con terbio caricata con un colorante fluorescente rosso (Alexa Fluor 594). Le pipette hanno riempito con successo le cellule bersaglio con il colorante e le hanno mantenute nella configurazione a cellula intera. Il team ha applicato lo stesso metodo alle preparazioni di sezioni acute del cervello in cui i neuroni si trovavano più in profondità in tessuti meno trasparenti rispetto ai neuroni in coltura. Quando Okamato et al. cellule piramidali rattoppate nelle fette acute dell'ippocampo usando pipette drogate con terbio, i neuroni hanno mostrato normali potenziali d'azione in risposta a brevi iniezioni di corrente. Le cellule hanno mostrato correnti postsinaptiche eccitatorie e inibitorie spontanee normali sotto la configurazione di tensione-clamp. Le micropipette potrebbero essere utilizzate per registrazioni stabili a lungo termine ed erano utili anche per registrazioni da neuriti. Il team ha registrato potenziali d'azione retropropaganti utilizzando la configurazione da dendriti mirati.
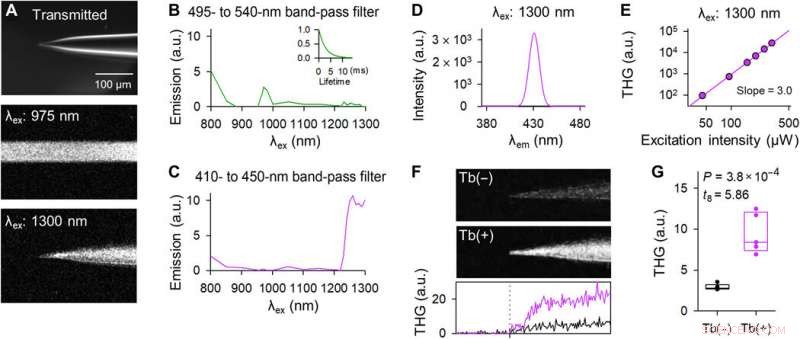
Le pipette drogate con Tb3+ emettono THG su eccitazione laser a 1300 nm. (A) Immagini rappresentative della punta di una pipetta drogata con Tb3+ nel campo chiaro (in alto), fluorescenza a due fotoni su eccitazione laser a 975 nm (al centro), ed emissione armonica a tre fotoni su eccitazione laser a 1300 nm (in basso). Le immagini centrale e inferiore sono state acquisite con una scansione orizzontale di 2 μs per pixel e z-stacked. (B) Lo spettro di eccitazione attraverso un filtro passa banda da 495 a 540 nm. Il grafico nel riquadro indica la curva di decadimento della fluorescenza all'eccitazione di 975 nm. (C) Lo stesso di (B) ma attraverso un filtro passa banda da 410 a 450 nm. (D) Lo spettro di emissione su eccitazione a 1300 nm è stato misurato utilizzando un monocromatore. (E) Doppio grafico logaritmico dell'intensità THG in funzione della potenza del laser a 1300 nm. La retta di regressione aveva una pendenza di 3.0. (F) Immagini THG delle punte del controllo (in alto) e delle pipette drogate con Tb3+ (al centro). Le immagini erano z-stacked. Il grafico in basso mostra l'intensità THG del controllo (nero) e delle pipette drogate con Tb3+ (viola). La linea tratteggiata verticale indica la posizione della punta. (G) Le intensità di THG delle pipette drogate con Tb3+ (viola) erano più forti di quelle delle pipette di controllo (nere). I rettangoli mostrano le mediane e il 25° e 75° percentile. n =5 pipette, Test t di studente. Credito fotografico:Teppei Ebina, L'Università di Tokio. Credito:progressi scientifici, doi:10.1126/sciadv.abd2529
Registrazioni in vivo patch-clamp utilizzando le pipette drogate con terbio
Okamato et al. next characterized the nonlinear multiphoton excitation of terbium-doped glass using infrared light at wavelengths that were approximately double the single-photon excitation peak (484 nm) of terbium. Using a photomultiplier tube through a 495-to-540 nm band-pass filter, the team captured the green fluorescence emitted by terbium-doped pipettes. The emissions peaked at an excitation wavelength of 975 nm, suggesting that a laser wavelength corresponding to the value excited the glass through a two-photon absorption process. The scientists also noted another bright signal at 1300 nm excitation through a 410-to-450 band pass filter and suggested the signal to have likely arisen from third harmonic generation (THG). Based on the strong THG signal of the micropipettes, Okamato et al. conducted in vivo whole cell patch-clamp recordings with a multiphoton laser microscope. They simultaneously used the cells and terbium-doped pipette using dual-laser irradiation at 1, 040 nm and 1, 300 nm, rispettivamente, and recorded the injection-induced action potentials and spontaneous membrane fluctuations under the current-clamp configuration.
THG-based in vivo patch-clamp recordings using Tb3+-doped pipettes. (A) Multiphoton image of an in vivo patch-clamp recording guided by THG of Tb3+-doped pipettes, targeting a cell labeled with tdTomato, which underwent two-photon excitation by a 1040-nm laser (red). The THG of the Tb3+-doped pipette was obtained using a 1300-nm laser (green). (B) Action potentials evoked by a step current injection (bottom) into a layer 2/3 pyramidal cell in the primary motor cortex (top) of an anesthetized mouse were recorded using a Tb3+-doped pipette. (C) Spontaneous membrane potentials were recorded using a Tb3+-doped pipette. Photo credit:Teppei Ebina, L'Università di Tokio. Credito:progressi scientifici, doi:10.1126/sciadv.abd2529 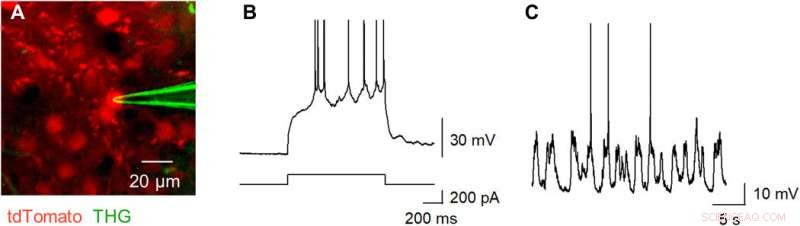
In questo modo, Kazuki Okamato and colleagues invented a terbium-doped glass emitting green fluorescence signal strong enough to be visible to the naked eye. The material had similar characteristics to conventional borosilicate glass and did not display photobleaching or cytotoxicity. The new micropipettes allowed fluorescence manipulations such as optical targeting of single-cell electroporation, single-cell RNA sequencing and electrophysiological recordings. The glass also emitted third harmonic generation upon three-photon excitation, applicable for in vivo manipulation. The terbium-doped glass therefore provided a platform for multiple purposes in biomedical research including hitherto conventional patch-clamp recordings to open new frontiers in life sciences.
© 2021 Science X Network