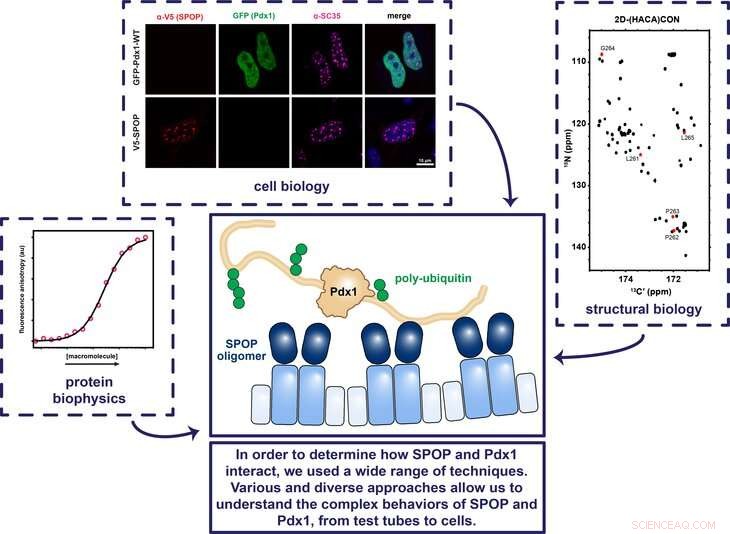
I ricercatori della Penn State hanno utilizzato una varietà di tecniche riguardanti la biologia cellulare, biologia strutturale, e la biofisica delle proteine per determinare come le proteine SPOP e Pdx1 lavorano insieme per garantire che il gene che codifica per l'insulina venga attivato e disattivato al momento giusto. Credito:Showalter Lab, Penn State
Alcune proteine nel corpo assicurano che i geni vengano attivati e disattivati al momento giusto. Per esempio, il fattore di trascrizione proteina Pdx1 (homeobox pancreatico e duodenale 1) accende il gene che codifica per l'insulina, e la proteina SPOP (proteina POZ di tipo speckle) a sua volta si lega a Pdx1 in modo che il corpo non produca troppa insulina. Ma non è chiaro come SPOP si leghi a Pdx1. Capire dove si lega SPOP può aiutare i ricercatori a prevedere cosa predispone gli individui a sviluppare il diabete e chiarire come SPOP regola altre proteine importanti. In un recente studio, un team di ricercatori della Penn State e del St. Jude Children's Research Hospital ha ripreso le proteine e ha determinato come avviene questa importante interazione.
Un articolo che descrive l'interazione è stato recentemente pubblicato nel Journal of Biological Chemistry . Abbiamo parlato con due degli autori del documento, Scott Showalter, professore di chimica e di biochimica e biologia molecolare, e Emery Usher, studente laureato in Biochimica, Programma di microbiologia e biologia molecolare (BMMB), su questo lavoro.
D:Perché Pdx1 è importante per il corpo umano, e in che modo SPOP supporta la sua funzione?
Showalter:Pdx1 è un fattore di trascrizione, che è una proteina che si lega al DNA nel tuo genoma e controlla se i geni vicini verranno attivati o disattivati. Negli umani, Pdx1 si trova principalmente nel pancreas, dove attiva il gene che codifica per la proteina insulina quando ne è necessaria una quantità maggiore. Quando viene immagazzinata una quantità sufficiente di insulina per il futuro, SPOP si lega a Pdx1 e ne provoca la distruzione da parte del macchinario di riciclaggio delle proteine cellulari, spegnendo così la produzione di insulina.
Usher:Alla fine, Pdx1 e SPOP lavorano insieme per mantenere l'omeostasi del glucosio; questo è, l'attento equilibrio dei livelli di glucosio nelle cellule e nel flusso sanguigno. In particolare, SPOP svolge un ruolo regolatore simile per dozzine di altre proteine in molti tipi diversi di cellule, tutto ciò è fondamentale per la funzione cellulare appropriata.
D:Qual è stata la tua motivazione per questo studio?
Showalter:Sebbene sapessimo che Pdx1 e SPOP lavorano insieme per regolare il gene che codifica l'insulina, prima di questo studio i dettagli di questa interazione non erano chiari. Era noto da altri lavori che SPOP disattiva le proteine allegando loro un segnale molecolare che prende di mira queste proteine per la distruzione, ma Pdx1 non assomiglia ad altre proteine regolate da SPOP. Quasi tutte le proteine note per essere regolate da SPOP possiedono sequenze di riconoscimento multiple, o sequenze di amminoacidi che fungono da password. Però, Pdx1 non contiene nessuna delle sequenze a cui era noto che SPOP si legava. Il mio laboratorio ha investito molto nell'ultimo decennio per sviluppare tecniche che possono essere utilizzate per caratterizzare interazioni come quelle che sapevamo dovessero esistere tra Pdx1 e SPOP. In questo studio, abbiamo deciso di determinare dove SPOP si lega a Pdx1 e come fa a sapere di aver trovato il/i sito/i corretto/i.
Usher:SPOP può effettivamente riconoscere più di una di queste sequenze di password di amminoacidi e può quindi prendere di mira molti partner, quindi è difficile produrre un elenco completo delle sequenze di amminoacidi che SPOP cerca. Lo studio dell'interazione tra Pdx1 e SPOP potrebbe anche fornire informazioni su altre proteine a cui SPOP potrebbe legarsi.
D:Quali sono stati i principali risultati di questo studio?
Showalter:Siamo stati molto felici di scoprire che non esiste un solo sito di legame SPOP su Pdx1, ma due. È noto che SPOP generalmente lega più siti nelle proteine che controlla, quindi questo risultato è stato molto soddisfacente perché porta la regolamentazione Pdx1 in linea con la comprensione più generale della comunità di come funziona SPOP. Dopo aver trovato il secondo sito di legame, abbiamo usato la cristallografia a raggi X per visualizzare il complesso che si forma quando SPOP è legato a Pdx1 in questi siti di legame appena scoperti. Questa struttura ha rivelato che anche se un'insolita sequenza di amminoacidi in Pdx1 era coinvolta nel legame di SPOP, i dettagli geometrici e chimici in realtà erano molto simili a strutture precedentemente determinate. I nostri risultati suggeriscono che la precedente definizione di un sito di legame SPOP era troppo stretta.
Usher:Ora abbiamo una migliore comprensione delle regole chimiche che definiscono se una sequenza è un buon candidato da legare o meno. La nostra struttura suggerisce anche un meccanismo plausibile per interrompere il legame di Pdx1 da parte di SPOP quando questa interazione è indesiderata, ad esempio, quando Pdx1 è necessario per produrre più insulina.
D:Perché questi risultati sono importanti?
Showalter:È importante comprendere i dettagli molecolari dei processi biologici come la produzione di insulina glucosio-dipendente e come sono regolati perché questi sono i fattori decisivi tra salute normale e malattia. Comprendere le sequenze a cui si lega SPOP ci aiuta a prevedere perché determinate variazioni genetiche possono predisporre individui e famiglie che li portano allo sviluppo del diabete. Allo stesso modo, chiarendo le regole che SPOP utilizza per identificare le proteine a cui dovrebbe legarsi e regolare, possiamo prevedere meglio altre proteine che regola. Potremmo anche essere in grado di prevedere come le variazioni naturali nelle loro sequenze di amminoacidi possano interrompere il normale legame di SPOP, portando a scarsi risultati di salute.
Usher:SPOP è noto anche per il suo ruolo in alcuni tipi di cancro, compreso il cancro della prostata e dell'endometrio. Sebbene al di fuori dello scopo del nostro lavoro attuale, definire meglio il modo in cui SPOP seleziona i partner vincolanti avrà probabilmente un impatto anche sulla ricerca futura in questo settore.