I peptidi sono brevi filamenti di amminoacidi che vengono sempre più utilizzati a scopo terapeutico, come biomateriali e come sonde chimiche e biologiche. La capacità di isolare, manipolare ed etichettare peptidi e proteine più grandi è tuttavia limitata dalla capacità di attaccare in modo affidabile molecole funzionali, come composti fluorescenti, ai peptidi in posizioni che non influiscono sulla struttura tridimensionale e sulla funzione delle proteine corte filamento di amminoacido.
I ricercatori sono più interessati ad aggiungere molecole funzionali all'estremità N-terminale o all'estremità di un peptide con un gruppo amminico libero (NH2 ), di un filamento di amminoacido al fine di ridurre al minimo l'interferenza delle molecole funzionali con la struttura e la funzione del peptide legato.
I metodi precedenti per attaccare le molecole funzionali all'estremità N dei peptidi erano insufficienti per diversi motivi:(1) i gruppi funzionali si sarebbero rilasciati dal peptide in condizioni fisiologiche umane, (2) solo un gruppo funzionale poteva essere attaccato a un peptide a livello tempo, (3) l'attaccamento delle molecole funzionali ai peptidi non era uniforme o (4) le reazioni semplicemente non erano efficienti.
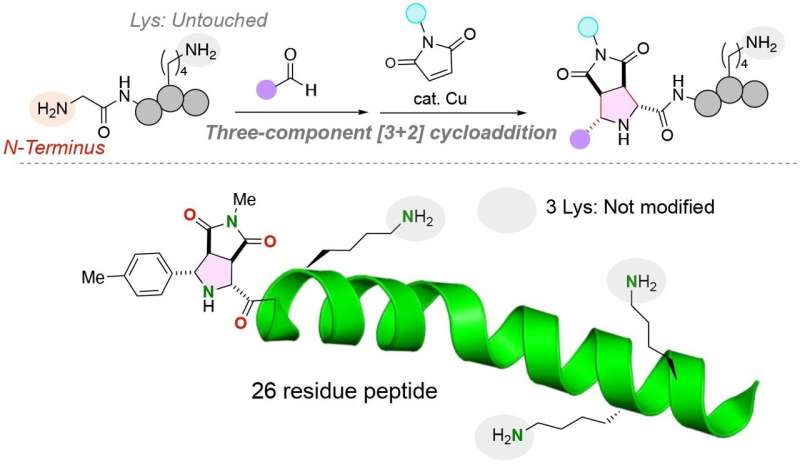
Per affrontare questo problema, i ricercatori dell’Università di Tohoku e dell’Università di Chuo hanno sviluppato una reazione chimica unica per attaccare due molecole funzionali distinte all’N-terminale di un peptide con un amminoacido glicina all’N-terminale. I ricercatori hanno pubblicato il loro studio nel numero del 28 gennaio 2024 della rivista Angewandte Chemie International Edition .
"La sfida [nel modificare le strutture peptidiche] sta nel raggiungere una modifica sito-selettiva, in particolare in presenza di residui di lisina altamente reattivi. Il nostro approccio è degno di nota per la sua capacità di funzionalizzare esclusivamente l'N-terminale dei peptidi, indipendentemente dai residui di lisina, risultando in coniugati strutturalmente uniformi con rese elevate.
"Inoltre, il protocollo a tre componenti facilita l'installazione simultanea di due molecole funzionali in un peptide", ha affermato Kazuya Kanemoto, autore senior dell'articolo e professore assistente presso la Graduate School of Pharmaceutical Sciences dell'Università di Tohoku in Giappone.
Il team ha collegato con successo le due distinte molecole funzionali all'amminoacido glicina utilizzando un catalizzatore di rame in una reazione a tre componenti di peptidi, aldeidi (qualsiasi composto organico con un atomo di carbonio che condivide un doppio legame con un atomo di ossigeno, un legame singolo con un atomo di idrogeno e un singolo legame con un altro atomo) e maleimmidi, molecole che sono importanti elementi costitutivi nelle reazioni di sintesi organica.
Sorprendentemente, la reazione viene eseguita in un unico recipiente in condizioni blande, risultando in una reazione molto efficiente con legami carbonio–carbonio stabili tra l'N-terminale del peptide e le molecole funzionali.
Gli amminoacidi della lisina, in particolare, hanno complicato l'aggiunta di molecole funzionali all'N-terminale dei peptidi. Il gruppo funzionale degli amminoacidi della lisina è un gruppo amminico che potrebbe potenzialmente competere con il gruppo amminico presente all'N-terminale di un filamento peptidico. È importante sottolineare che la reazione chimica sviluppata dal gruppo di ricerca etichetta solo il gruppo N-terminale dei peptidi anime, anche se nel peptide è presente un amminoacido lisina, contenente un gruppo amminico alternativo.
Il gruppo di ricerca ha scoperto che l'attacco N-terminale dei gruppi funzionali ai peptidi potrebbe essere ottimizzato per una varietà di di-, tri- e oligopeptidi, dimostrando la potenziale utilità della reazione nell'etichettatura di diversi peptidi e proteine potenzialmente più grandi per la purificazione, il rilevamento e altri scopi .
I ricercatori stanno già testando la funzione dei peptidi che sono stati modificati attraverso la loro nuova reazione per determinare l'idoneità del prodotto finale per vari scopi di ricerca e terapeutici.
"I nostri passi successivi prevedono la valutazione dell'attività biologica dei peptidi preparati da questa reazione. Inoltre, miriamo a estendere l'applicazione di questo protocollo di doppia modificazione selettiva del sito a peptidi più grandi come proteine e anticorpi, promettendo progressi nella somministrazione di farmaci," disse Kanemoto.
Ulteriori informazioni: Haruka Machida et al, Doppia modificazione specifica N-terminale dei peptidi attraverso cicloaddizione catalizzata da rame [3+2], Angewandte Chemie International Edition (2024). DOI:10.1002/anie.202320012
Fornito dall'Università di Tohoku