I ricercatori della McMaster University hanno scoperto le caratteristiche uniche di un meccanismo utilizzato dai batteri per resistere a un’importante classe di antibiotici. La nuova ricerca, pubblicata su Nature Chemical Biology , dimostra che la resistenza ai farmaci aminoglicosidici, utilizzati per trattare una varietà di infezioni, è molto più complessa di quanto si pensasse inizialmente.
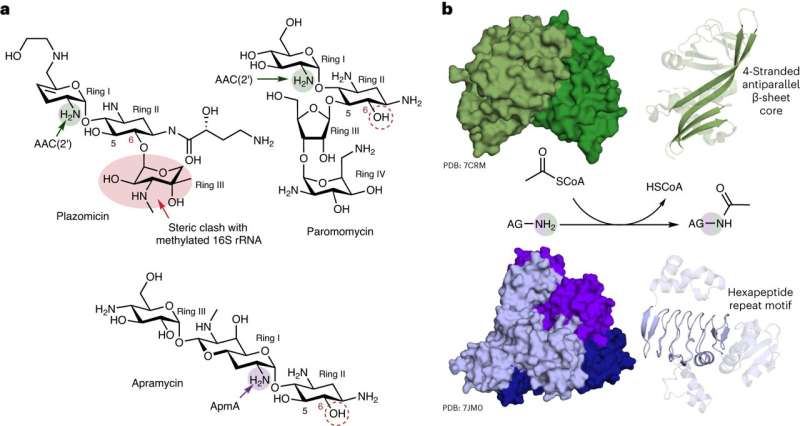
Il ricercatore capo Gerry Wright, professore di biochimica e scienze biomediche alla McMaster, afferma che il suo laboratorio ha osservato una versatilità mai vista prima nell'ApmA, un gene di resistenza batterica a lungo studiato. La ricerca ha dimostrato che il gene può insolitamente consentire ai batteri di svolgere funzioni diverse contro diversi antibiotici.
Degli oltre cento enzimi di resistenza agli aminoglicosidi noti ai ricercatori, Wright afferma che solo questo ha mostrato un comportamento così agile.
"È un unicorno", dice. "Ha un aspetto diverso, funziona in modo diverso e appartiene a una famiglia di enzimi completamente diversa. È completamente diverso da tutti i meccanismi di resistenza che associamo a questa classe di antibiotici."
Wright, membro del Michael G. DeGroote Institute for Infectious Disease Research, afferma che gli aminoglicosidi sono stati tra i primi antibiotici con rilevanza clinica e i primi in assoluto ad essere utili contro la tubercolosi. Ma poiché vengono prescritti sin dagli anni '40, afferma che "la resistenza ad essi è diventata un vero problema", tranne nel caso dell'apramicina.
"L'antibiotico apramicina evita la maggior parte dei meccanismi di resistenza e quindi è un forte candidato per nuove applicazioni cliniche", afferma. "Purtroppo il meccanismo che abbiamo studiato non può essere evitato dal farmaco."
Wright afferma che la recente scoperta del suo laboratorio è significativa perché l'apramicina è attualmente in fase di sperimentazione clinica e, se dovesse passare, avere una conoscenza approfondita di come i batteri potrebbero resistere al farmaco sarà fondamentale per estenderne l'utilità.
"Se vogliamo portare questo farmaco sul mercato, allora sarà meglio sapere qual è il nemico", dice. "Imparare di più su questo esclusivo meccanismo di resistenza potrebbe fornire informazioni utili per la ricerca successiva sull'apramicina di prossima generazione o per la diagnostica in grado di rilevare l'ApmA nei batteri."
Ulteriori informazioni: Emily Bordeleau et al, La plasticità meccanicistica in ApmA consente la promiscuità degli aminoglicosidi per la resistenza, Nature Chemical Biology (2023). DOI:10.1038/s41589-023-01483-3
Informazioni sul giornale: Natura Biologia Chimica
Fornito dalla McMaster University