I peptidi sono biomolecole che si formano quando due o più aminoacidi che svolgono funzioni chiave nell'organismo umano, come ormoni, neurotrasmettitori, antidolorifici e antibiotici, si legano insieme. Per questo motivo sono molto studiati e utilizzati, ad esempio, dall'industria farmaceutica.
Uno studio condotto da scienziati del Dipartimento di Biofisica della Facoltà di Medicina dell'Università Federale di San Paolo (EPM-UNIFESP) in Brasile ha identificato cambiamenti significativi nelle proprietà fisico-chimiche dei peptidi durante un processo spontaneo di cambiamento chimico chiamato piroglutaminazione.
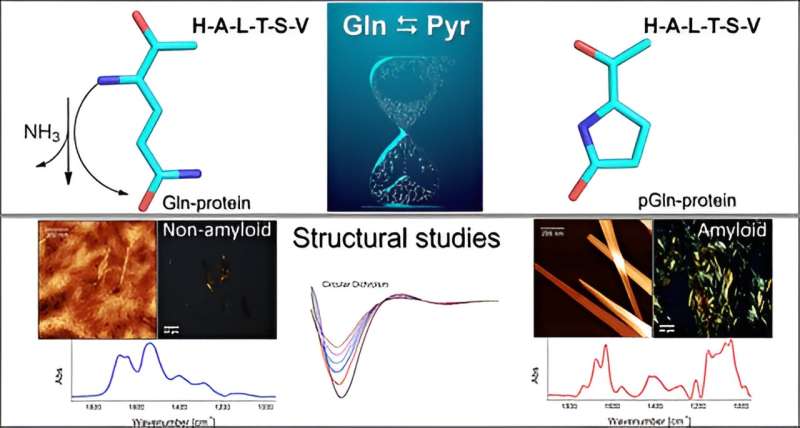
La piroglutaminazione è una modificazione risultante dalla conversione spontanea della glutammina in acido piroglutammico, con un impatto significativo sulle proprietà fisiche e chimiche dei peptidi. Si tratta di una parte ben nota ma spesso trascurata della sintesi peptidica e raramente esplorata in proteomica.
I ricercatori che hanno condotto lo studio sottolineano che può verificarsi rapidamente e accelera con l’aumento della temperatura, sottolineando la necessità di cautela durante gli esperimenti di laboratorio per prevenire la ciclizzazione della glutammina. È particolarmente importante in condizioni che imitano ambienti fisiologici in cui le temperature sono nell'intervallo di 37° C, la temperatura normale di un organismo umano sano.
La scoperta ha implicazioni per la ricerca di laboratorio e apre nuove prospettive per lo studio delle malattie neurodegenerative come l'Alzheimer e il Parkinson, poiché dopo la modificazione chimica la molecola acquisisce una struttura amiloide, che favorisce l'aggregazione delle molecole, formando placche come quelle ritenute causa delle malattie in questione.
Un articolo sullo studio è pubblicato su Biochemistry .
Il gruppo ha condotto esperimenti in vitro per studiare il meccanismo mediante il quale l'amminoacido glutammina (Gln) diventa acido piroglutammico (Pyr) in presenza di una sequenza peptidica o proteica all'estremità N-terminale. Questo processo avviene attraverso la deammidazione, una reazione che elimina l'ammoniaca (NH3 ). Pyr (chiamato anche piroglutammato) è un amminoacido ciclico formato a seguito della disidratazione del glutammato. Tutte le proteine sono costituite da più amminoacidi uniti insieme da legami peptidici, con variazioni nel numero e nella sequenza degli amminoacidi.
"Il risultato può servire da modello per molti ricercatori che lavorano con i peptidi. Siamo arrivati a due scoperte chiave. Siamo tornati a un vecchio argomento, ovvero il modo in cui la glutammina si scompone in acido piroglutammico, ma abbiamo introdotto un avvertimento sull'importanza di analizzare la sequenza. Il secondo punto è che dopo la conversione del peptide, le sue caratteristiche cambiano e tende ad aderire alle membrane."
"La presenza di acido piroglutammico favorisce la formazione di aggregati amiloidogenici, simili ai conglomerati tipici dei casi di malattie neurodegenerative. Queste placche amiloidi si formano nel cervello e interrompono il flusso dei neuroni", ha affermato Clovis Ryuichi Nakaie, ultimo autore dello studio. articolo.
La sequenza peptidica modello (QHALTSV-NH2) utilizzata nello studio ha avuto origine nel dottorato di ricerca. ricerca di Mariana Machado Leiva Ferreira, prima autrice dell'articolo, mentre cercava una sintesi di circa due dozzine di peptidi presenti nelle sequenze di cinque recettori accoppiati a proteine G (GPCR) di dimensioni variabili fino a circa 20 aminoacidi. I GPCR catturano un'ampia gamma di segnali extracellulari (che vanno dai fotoni agli ioni, proteine, neurotrasmettitori e ormoni) e attivano percorsi di segnalazione all'interno delle cellule.
Uno dei peptidi sintetizzati da Ferreira si distinse per la sua bassa resa ed era l'unico con glutammina all'estremità amminica. "Dopo il primo tentativo di sintesi con una resa molto bassa, abbiamo variato diversi parametri per aumentare la produzione del peptide, comprese modifiche alla parte sintetica e al processo di purificazione, ma sfortunatamente il peptide è sempre parzialmente degradato," ha affermato.
Quando il gruppo ha testato soluzioni frequentemente utilizzate negli esperimenti di proteomica, ha scoperto che la conversione della glutammina in acido piroglutammico avveniva in tutte in funzione del tempo, secondo la tipica cinetica del primo ordine, dove il tasso di conversione era proporzionale al tempo impiegato dalla reazione. Hanno quindi deciso di non agitare la soluzione in modo da poter dedurre il tasso di conversazione. Ad esempio, hanno stimato che dopo cinque ore almeno il 10% della glutammina si sarebbe probabilmente convertito in acido piroglutammico.
Un piccolo cambiamento strutturale innescato quando il peptide nativo è stato piroglutamminato all'estremità N-terminale è stato sufficiente per modificare il comportamento fisico-chimico della molecola.
"Poiché è ciclico e ha una carica positiva in meno, il peptide Pyr dovrebbe essere più idrofobo della molecola nativa, e quindi ci aspettavamo che l'analogo interagisse con i sistemi mimetici di membrana. Ciò che non avevamo previsto era che l'analogo avrebbe comportato la formazione di strutture amiloidi come quelle osservate nelle malattie neurodegenerative. Non abbiamo studiato nessuna di queste, ma i nostri risultati vanno in questa direzione", ha detto ad Agência FAPESP Emerson Rodrigo da Silva, penultimo autore dell'articolo. Silva e Nakaie sono gli autori corrispondenti.
Nakaie ha sottolineato l'importanza dei cambiamenti post-traduzionali nell'organismo che coinvolgono la catena polipeptidica. Svolgono un ruolo nella diversità funzionale delle proteine e consentono l'adattamento di una sequenza di amminoacidi codificati da un gene per svolgere varie funzioni regolatrici.
"In questo contesto, il tempo come fattore sarà sempre correlato al verificarsi dei cambiamenti, indipendentemente dalla loro velocità o dalla loro localizzazione nel nostro organismo. Questo richiama l'idea dell'orologio biologico ed è il motivo per cui abbiamo proposto di mettere una clessidra sulla copertina del diario per simboleggiare la conversione spontanea di Gln in Pyr," ha detto Nakaie.
È professore all'EPM-UNIFESP da 45 anni e ha sottolineato il lavoro innovativo svolto dal gruppo del Dipartimento di Biofisica. In particolare, ha osservato, hanno introdotto in Brasile la sintesi e la biochimica dei peptidi e dei derivati degli amminoacidi.
"I nostri risultati apriranno senza dubbio la strada a ulteriori studi. Dopo aver completato il lavoro di cui faceva parte la ricerca di dottorato di Mariana Ferreira, vogliamo proseguire anche con questa linea di ricerca", ha affermato.
Ulteriori informazioni: Mariana M. L. Ferreira et al, Cambiamenti indotti dalla piroglutaminazione nelle caratteristiche fisico-chimiche di un peptide di chemochina CXCR4:analisi cinetica e strutturale, biochimica (2023). DOI:10.1021/acs.biochem.3c00124
Informazioni sul giornale: Biochimica
Fornito da FAPESP