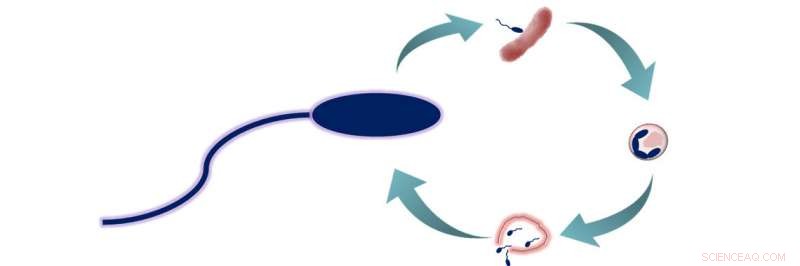
B. bacteriovorus ciclo di predazione. B. bacteriovorus ha due fasi di vita:1) ricerca di prede, e 2) entrare nella preda e nutrirsi. Durante questa seconda fase, i batteri consumano la loro preda dall'interno, permettendo loro di crescere e allungarsi prima di separarsi in 3-6 nuove cellule di B. bacteriovorus. Queste cellule poi sfuggono alla preda ormai morta e iniziano un nuovo ciclo di vita. Credito:American Chemical Society
Nel 2016, l'Organizzazione Mondiale della Sanità ha definito la resistenza agli antibiotici come "una delle più grandi minacce per la salute globale, sicurezza del cibo, e lo sviluppo oggi." L'annuncio citava un elenco crescente di infezioni, come la tubercolosi e la gonorrea, che stanno diventando ogni anno più difficili da trattare man mano che aumenta la resistenza agli attuali trattamenti antibiotici. Eppure gli antibiotici sono essenziali, senza di loro, la razza umana sarebbe afflitta da infezioni persistenti. Quindi qual è la soluzione per garantire un trattamento continuo e allo stesso tempo affrontare l'allarmante aumento della resistenza?
Una potenziale soluzione risiede in un tipo unico di batteri predatori che si nutre di altri batteri, come quelli che causano malattie. Soprannominato "antibiotici vivi, " questo gruppo di fauna carnivora ha catturato l'attenzione dei ricercatori, compresi quelli dell'Okinawa Institute of Science and Technology Graduate University (OIST). In un articolo recentemente pubblicato in Biologia sintetica ACS , I ricercatori dell'OIST hanno mosso i primi passi verso la manipolazione genetica di uno di questi piccoli cannibali, B. batteriovorus. Hanno identificato strumenti che possono consentire la manipolazione dei geni che influenzano il comportamento predatorio di questo batterio.
"Nel futuro, vogliamo controllare la predazione dei batteri, la tempistica e l'entità della predazione, " spiega il dott. Mohammed Dwidar della Nucleic Acid Chemistry and Engineering Unit e primo autore dell'articolo. "[Al momento] ci mancano gli strumenti ingegneristici di base per farlo".
B. bacteriovorus è innocuo per l'uomo ma letale per la sua preda, i batteri Gram-negativi, che include cattivi come E. coli, Salmonella, Legionella, e altri. Come tale, essere in grado di controllarlo potrebbe potenzialmente trattare molti diversi tipi di infezioni. Però, a causa della sua insolita natura predatoria e di altre caratteristiche uniche, la manipolazione genetica di B. bacteriovorus è stata limitata.
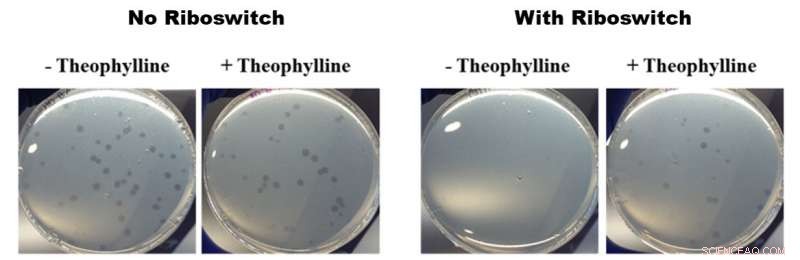
Effetti dei riboswitch attivati dalla teofillina sulla crescita di B. bacteriovorus. Tutte le foto nella figura sopra mostrano piastre di Petri contenenti B. bacteriovorus e la sua preda E. coli. Le due foto a sinistra mostrano la crescita di B. bacteriovorus in piatti non contenenti (-) e contenenti (+) teofillina senza un riboswitch inserito nel genoma. Le due foto di destra mostrano la crescita di B. bacteriovorus modificato con un riboswitch in piatti non contenenti (-) e contenenti (+) teofillina. Le foto di sinistra non mostrano alcuna differenza nella crescita e le foto di destra mostrano una crescita più rapida in presenza di teofillina, il che significa che i riboswitch attivati dalla teofillina hanno avuto un effetto sul comportamento predatorio di B. bacteriovorus. Credito:American Chemical Society
I ricercatori dell'OIST hanno utilizzato riboswitch, che sono strumenti di controllo dell'espressione genica noti per funzionare bene in altri batteri, per affrontare la sfida di comprendere e manipolare la predazione di B. bacteriovorus. Il modo in cui un gene viene espresso segue un percorso specifico:il DNA viene convertito in RNA tramite trascrizione, L'RNA viene convertito in proteine tramite traduzione, e quindi le proteine svolgono diverse funzioni. Il riboswitch entra in fase di traslazione. Mettendo un riboswitch all'inizio di un filamento di RNA, e poi "attivandolo" con una sostanza chimica, il riboswitch può avviare o interrompere la traduzione dell'RNA in una proteina.
Per il loro studio, i ricercatori dell'OIST hanno inserito un riboswitch in uno dei geni ritenuti importanti per il comportamento predatorio di B. bacteriovorus:il fattore sigma flagellare fliA. Lo hanno poi attivato con la teofillina chimica. Dopo aver collocato i batteri modificati in piastre di Petri insieme ad alcune deliziose prede di E. coli, il B. bacteriovorus modificato sembrava moltiplicarsi più rapidamente in presenza di teofillina che in sua assenza. Questa moltiplicazione più rapida implica che B. bacteriovorus stava consumando la sua preda più velocemente, e quindi moltiplicando più velocemente. Questo a sua volta mostra che il ciclo vitale predatorio può essere controllato dalla teofillina.
Oltre all'obiettivo finale "antibiotico vivente", ci sono molti altri potenziali usi per le cellule di B. bacteriovorus facilmente manipolabili. "La gente vuole cibo biologico senza prodotti chimici, " Il Dr. Dwidar spiega. "I batteri predatori possono essere un'alternativa potenzialmente sicura agli agenti antibatterici per alcune malattie delle piante. Possiamo anche usarlo per l'industria, Per esempio, negli impianti di trattamento delle acque”.
"Nel futuro, potresti spruzzare questi batteri sul cibo fresco per proteggerti dall'intossicazione alimentare, "Professore Yohei Yokobayashi, che è stato anche coinvolto nella ricerca, aggiunge.
Con i risultati dei ricercatori dell'OIST alla mano, il passo successivo è quello di saperne di più su B. bacteriovorus e sugli strumenti che potrebbero essere in grado di controllarne il comportamento per realizzare un giorno il suo pieno potenziale antibiotico.