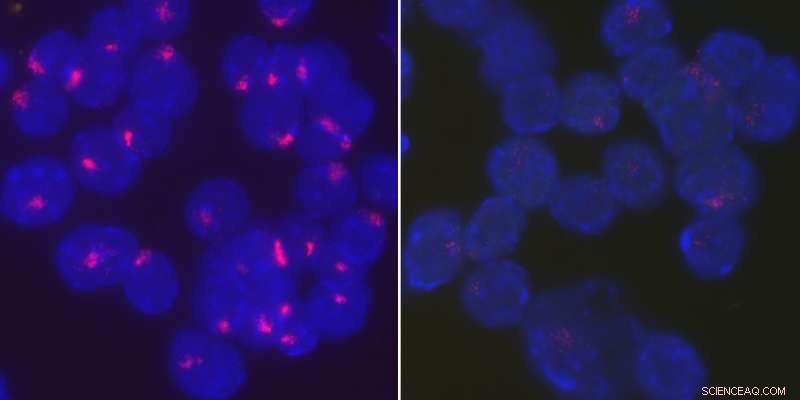
I ricercatori hanno scoperto che la proteina YY1 riporta l'RNA Xist al cromosoma X inattivo per mantenere l'inattivazione del cromosoma X nelle cellule B stimolate. attivato, le cellule B wild type di topi femmina localizzano strettamente l'RNA Xist sui loro cromosomi X inattivi (a sinistra), mentre l'RNA Xist si disperde in tutto il nucleo quando YY1 viene eliminato (a destra). Credito:Università della Pennsylvania
Le malattie autoimmuni tendono a colpire le donne più degli uomini e avere più cromosomi X potrebbe essere la ragione principale per cui. Mentre un processo chiamato inattivazione del cromosoma X serve a bilanciare il dosaggio genico tra maschi e femmine, alcuni geni sul cromosoma "X inattivo" nelle cellule immunitarie possono talvolta sfuggire a questo processo, dando alle donne una dose extra di espressione genica correlata all'immunità.
In un nuovo studio, un team dell'Università della Pennsylvania descrive come l'inattivazione del cromosoma X è regolata nelle cellule B del sistema immunitario mentre si sviluppano nel midollo osseo e quando incontrano gli antigeni. Il loro lavoro chiarisce una dinamica, meccanismo in due fasi nelle femmine per cui le cellule B prive dei marcatori di inattivazione del cromosoma X riacquistano queste modifiche durante l'attivazione delle cellule B, in un processo che coinvolge il fattore di trascrizione YY1.
"La cosa notevole è che le cellule B sono quelle che producono anticorpi e autoanticorpi, quindi sono davvero cruciali sia nelle risposte immunitarie protettive che nell'autoimmunità, " disse Montserrat C. Anguera, assistente professore presso il Dipartimento di Scienze Biomediche della Penn's School of Veterinary Medicine e autore senior dello studio. "Una grande domanda che rimane è, Perché queste cellule immunitarie preparano questo cromosoma a essere regolato in modo diverso e inoltre, Se questi processi vanno male, in che modo questo porta all'autoimmunità e alla perdita di autotolleranza?"
Lo studio, pubblicato in Genetica PLOS , era guidata da Camille M. Syrett, uno studente di dottorato nel laboratorio di Anguera. Coautori, in rappresentanza sia di Penn Vet che della Penn's Perelman School of Medicine, erano Vishal Sinhava, Suchita Hodawadekar, Arpita Myles, Guanxiang Liang, Yue Zhang, Satabdi Nandi, Michael Cancro e Michael Atchison.
In uno studio dell'anno scorso sulla rivista Atti dell'Accademia Nazionale delle Scienze , Anguera e colleghi hanno scoperto che ingenuo, linfociti femminili non stimolati, le cellule B e T del sistema immunitario, non è riuscito a inattivare completamente un cromosoma X. La ricerca ha mostrato che ciò era dovuto al fatto che Xist, un lungo trascritto di RNA non codificante ben noto per avviare e mantenere il processo di inattivazione del cromosoma X, non è riuscito a localizzarsi sul cromosoma X inattivo. Quando le cellule immunitarie sono state attivate, o innescato per rispondere all'infezione, Xist RNA è riapparso nella posizione corretta.
"Abbiamo visto che le cellule B inattivate non hanno questa nuvola di RNA, ma ritorna alla stimolazione, " ha detto Syrett. "Eravamo davvero interessati a determinare cosa sta riportando indietro l'RNA Xist."
Utilizzando una molecola tracciante fluorescente, il team ha iniziato tracciando la posizione di Xist nello sviluppo di cellule B nei topi femmina. Hanno scoperto che i precursori delle cellule B, come le cellule staminali ematopoietiche e i comuni progenitori linfoidi, aveva modelli chiari di Xist RNA sul cromosoma X inattivo. Ma, poiché questi precursori delle cellule B hanno seguito un percorso di sviluppo per diventare cellule B, L'RNA di Xist sembrava scomparire per la prima volta, poi riapparire, ma solo come punture di spillo diffuse attraverso il nucleo invece di essere localizzate nell'X inattivo.
Inoltre, tag di piccole molecole chiamate modificazioni dell'eterocromatina, che sono noti per mantenere la repressione genica durante l'inattivazione del cromosoma X, scomparve durante lo sviluppo delle cellule B.
"Potremmo vedere questi cambiamenti davvero insoliti a livello di cromatina che si verificano nello sviluppo delle cellule B femminili, " disse Anguira.
Per scoprire come la Xist è tornata alla X inattiva dopo l'attivazione delle cellule B, come avevano mostrato nel documento PNAS dell'anno scorso, i ricercatori hanno monitorato l'RNA Xist nelle cellule B in coltura. Hanno scoperto che la ricomparsa è avvenuta in due fasi distinte:tra le quattro e le 16 ore dopo che le cellule sono state stimolate, cominciarono ad apparire le macchioline di Xist RNA. E tra 16 e 30 ore dopo la stimolazione, Xist RNA concentrato esclusivamente sul cromosoma X inattivo. Anche in questa seconda fase le modificazioni dell'eterocromatina sembravano aumentare e localizzarsi sull'X inattivo.
Il precedente studio del team aveva indicato che la proteina YY1 aveva un ruolo nel ritorno di Xist nelle cellule B attivate, così hanno cominciato a guardarlo più da vicino in questo lavoro. Atchison, leader negli studi di YY1 nello sviluppo delle cellule B, è stato in grado di prestare la sua esperienza per studiare il ruolo della proteina nell'inattivazione del cromosoma X.
Quando i ricercatori hanno esaminato le cellule B di topi privi di YY1, hanno visto livelli notevolmente ridotti di segni di eterocromatina e una minore localizzazione dell'RNA Xist sull'X inattivo.
Il team ha anche osservato prove che YY1 stava influenzando l'espressione dei geni del cromosoma X. Quando hanno eliminato YY1 dalle cellule maschili e femminili e confrontato i geni che erano espressi in modo differenziale sul cromosoma X, hanno trovato 68 specifici per le femmine, uno specifico per i maschi e 11 condivisi.
Dei 68 geni specifici delle femmine, molti erano legati all'immunità, e almeno due sono noti per essere sovraespressi nelle cellule B femminili umane rispetto alle cellule B maschili.
Un'ulteriore serie di esperimenti ha identificato l'area di YY1 con attività di legame al DNA come il dominio chiave di questa proteina coinvolta nel portare l'RNA Xist all'X inattivo.
"Sembra agire come un vincolo, portando l'RNA Xist insieme al DNA del cromosoma X inattivo, " disse Anguira.
Lei e i suoi colleghi esploreranno ulteriormente il ruolo di YY1, utilizzando campioni clinici e modelli murini, esaminare la proteina in malattie come il lupus per approfondire la loro comprensione di come l'autoimmunità potrebbe derivare dalla "fuga" dei geni immuni dall'inattivazione del cromosoma X.
"Se vuoi sviluppare una terapia per le malattie autoimmuni, l'idea è, Come possiamo portare Xist al cromosoma X inattivo e mantenerlo lì in modo da mantenere la compensazione del dosaggio in queste cellule B", ha detto Anguera. "Certamente YY1 sembra un obiettivo davvero promettente".