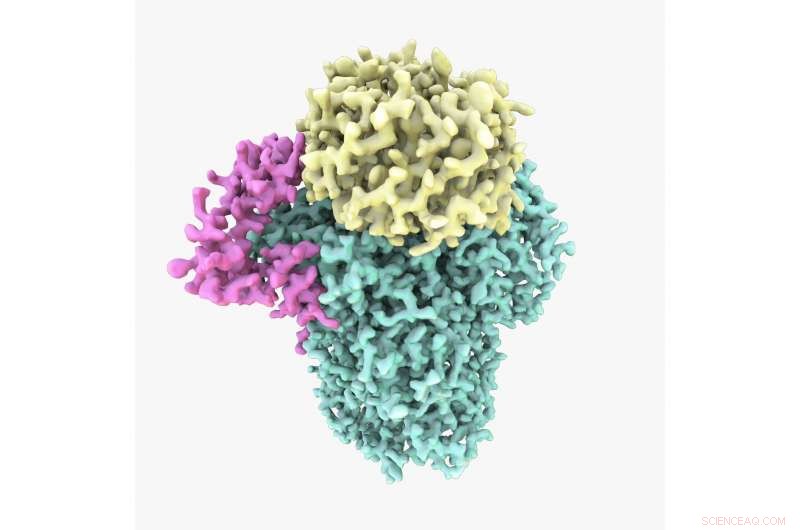
Struttura Cryo-EM della proteina CPF. Lo studio ha mostrato che il CPF è assemblato da tre subunità:Cft1 in verde, Yth1 in magenta e Pfs2 in giallo. Credito:A. Casañal e T. Martin presso MRC LMB
La tecnica della microscopia crioelettronica, per la quale lo scienziato dell'MRC, il dottor Richard Henderson, ha vinto un premio Nobel all'inizio di questo mese, è stata ora utilizzata per risolvere la struttura di un complesso proteico critico per l'espressione genica.
Nella carta, pubblicato su Sciencesi apre in una nuova finestra, i ricercatori affermano che la struttura indica come il virus dell'influenza umana è in grado di interrompere il meccanismo di espressione genica delle cellule.
Lo studio, condotto dalla dott.ssa Lori Passmoresi apre in una nuova finestra dal Laboratorio di Biologia Molecolare MRC, è il primo a rivelare la struttura di una parte importante della proteina, chiamato clivaggio e fattore di poliadenilazione (CPF).
CPF è un enzima complesso costituito da molte subunità. La microscopia crioelettronica ha rivoluzionato la capacità degli scienziati di scoprire la struttura di grandi, proteine flessibili e complesse come questa nella loro forma naturale.
La dottoressa Lori Passmore, autore senior del documento e leader del gruppo presso l'MRC LMB, ha detto:"Comprendendo la struttura e la funzione del CPF intatto, e come è assemblato, è stata una questione centrale nel campo dell'espressione genica per decenni:è una proteina fondamentale ma ancora non capiamo come funziona. Questa è stata un'enorme sfida tecnica perché pochissime strutture sono state costruite interamente da zero utilizzando dati crio-EM. Eravamo molto entusiasti di costruire finalmente il primo modello atomico della struttura di una parte del CPF".
Il CPF dà la coda all'espressione genica
L'espressione genica - trasformare le istruzioni codificate nel DNA in proteine - richiede una serie di passaggi importanti. Gli enzimi copiano il gene e producono una versione a filamento singolo del DNA, chiamato RNA messaggero (mRNA).
L'mRNA può uscire dal nucleo della cellula, dove è alloggiato il DNA, al citoplasma dove il macchinario cellulare utilizza le istruzioni dell'mRNA per assemblare una proteina.
L'enzima CPF è una parte necessaria di questo processo:aggiunge una lunga serie di molecole di adenosina, chiamato "coda poli-A", alla fine di ogni nuovo mRNA.
Questa coda è importante perché la lunghezza della coda specifica la quantità di tempo in cui l'mRNA è presente nella cellula, e quanto spesso viene tradotto in proteine. La coda di poli-A è necessaria anche per il trasporto dell'mRNA fuori dal nucleo.

Credito:Consiglio di ricerca medica
Nel mirino dell'influenza
Infezione virale, come l'influenza, target CPF all'interno della cellula e interrompono l'espressione genica. I ricercatori hanno identificato un sito sul CPF in cui una proteina del virus può legarsi in un modo che potrebbe impedire al CPF di interagire con l'mRNA, e quindi arrestare l'espressione genica nella cellula a vantaggio del virus.
Gli scienziati affermano che questa struttura li aiuterà anche a capire meglio come funziona il CPF e come i difetti nell'aggiunta della coda di poli-A contribuiscono alle malattie, tra cui la β-talassemia, trombofilia, e cancro.
Il dottor Passmore ha dichiarato:"Questo è stato un progetto a lungo termine nel mio laboratorio e molte persone hanno contribuito ad esso negli ultimi sette anni. Ricordo ancora di aver visto le prime immagini di CPF nel 2010. Ora, avere la struttura del CPF consentirà la ricerca futura su come questa importante proteina funziona nelle cellule normali, ma apre anche opportunità per comprendere il suo ruolo nelle infezioni virali e in malattie come il cancro".