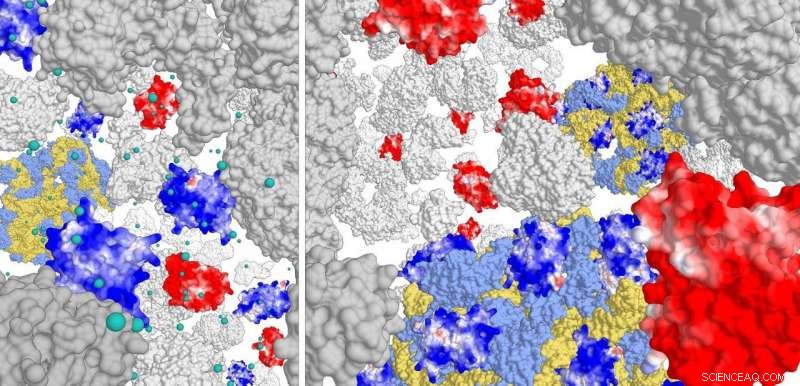
Pannello di destra:interazione di proteine caricate positivamente (blu scuro) con il complesso ribosoma (azzurro/giallo). Le proteine con carica negativa non interagiscono. Ad alta forza ionica (pannello di sinistra) le proteine positive difficilmente interagiscono con il ribosoma. Credito:laboratorio Poolman, Università di Groninga
Le cellule sono affollate di macromolecole, che limita la diffusione delle proteine, specialmente nelle cellule procariotiche senza trasporto attivo nel citoplasma. Indagando sulla relazione tra affollamento, forza ionica e diffusione delle proteine, I biochimici dell'Università di Groningen hanno fatto una scoperta affascinante:le proteine caricate positivamente si attaccano alla superficie dei complessi ribosomiali. Questo spiega perché la maggior parte delle proteine idrosolubili trasporta una carica negativa complessiva. La scoperta apparirà presto sul diario eLife .
La velocità di movimento delle proteine all'interno delle cellule è importante:molti processi nelle cellule biologiche dipendono dalle interazioni tra le macromolecole (proteine e acidi nucleici) e quindi dalla loro capacità di ritrovarsi. "Ma il citoplasma cellulare è un luogo vivace e questo influenzerà la diffusione di proteine e RNA", commenta Bert Poolman, professore di biochimica dell'Università di Groningen.
Spese
Il suo gruppo ha studiato gli effetti dell'affollamento sulla diffusione, e ha trovato una correlazione tra la dimensione della proteina e la velocità di diffusione. "Ma per alcune proteine non abbiamo trovato questa correlazione, così abbiamo deciso di indagare sul perché.' Il team ha utilizzato tre diversi procarioti con forza ionica crescente:il batterio Gram-negativo Escherichia coli, il Gram-positivo Lactococcus lactis e l'estremofilo Haloferax volcanii, che vive ad altissime concentrazioni di sale.
Per questo studio, i ricercatori hanno costruito diverse varianti di Green Fluorescent Protein (GFP), con cariche superficiali comprese tra -30 e +25. Hanno quindi studiato il movimento di queste varianti GFP nei tre tipi di cellule. "Abbiamo visto che le proteine con carica positiva si diffondono molto lentamente. Sono rimasti bloccati nella cella', spiega Poolman. Ulteriori analisi hanno mostrato che le proteine positive non si legano al DNA o alla membrana cellulare ma al complesso ribosoma.
Interessante
Un'analisi bioinformatica dei proteomi dei microrganismi e delle cellule eucariotiche ha mostrato che nella maggior parte dei casi circa il 70% delle proteine è caricato negativamente. 'Interessante, il restante 30 percento sono proteine di membrana o proteine coinvolte nel funzionamento o nel ripiegamento del ribosoma o dell'mRNA.'
Le proteine di membrana sono schermate da chaperon durante la biogenesi, quindi non si attaccano ai ribosomi. Non esistono quindi proteine citoplasmatiche "libere" con una carica positiva sufficientemente alta da farle depositare sui ribosomi. La carica negativa del complesso ribosomico e la forza ionica ambientale del citoplasma sembrano aver modellato l'evoluzione delle cariche nel proteoma cellulare.
Inaspettato
La nuova e inaspettata intuizione che la mobilità delle proteine è una funzione della carica proteica può spiegare perché è difficile esprimere alcune proteine in sistemi batterici con bassa forza ionica. 'Abbiamo osservato che una forza ionica più elevata riduce la viscosità delle proteine caricate positivamente. Questa potrebbe essere una preziosa intuizione per la costruzione di piattaforme di espressione proteica.'
Un'ultima osservazione nel documento eLife è che i genomi di diversi endosimbionti mostrano un'abbondanza di proteine caricate positivamente. "Questa scoperta ci sconcerta davvero", ammette Poolman. 'Ci si aspetterebbe che tutte queste proteine siano attratte dai ribosomi endosimbionti. Finora, non abbiamo alcuna spiegazione di come questi organismi siano in grado di affrontare la diffusione lenta ei ribosomi che vengono inghiottiti da proteine positive.'