Astratto grafico. Credito:Cellula molecolare (2022). DOI:10.1016/j.molcel.2022.08.029
In uno studio del laboratorio del membro del Whitehead Institute David Bartel, i ricercatori hanno identificato sequenze genetiche che possono portare alla degradazione dei regolatori cellulari chiamati microRNA nel moscerino della frutta Drosophila melanogaster. I risultati sono stati pubblicati il 22 settembre su Molecular Cell .
"Questo è uno studio entusiasmante che apre la strada a una comprensione più profonda del percorso di degradazione del microRNA", afferma Bartel, che è anche professore di biologia presso il Massachusetts Institute of Technology e ricercatore presso l'Howard Hughes Medical Institute. "Trovare queste sequenze 'trigger' ci consentirà di sondare con maggiore precisione il funzionamento di questo percorso in laboratorio, che è probabilmente fondamentale per le mosche, e forse altre specie, per sopravvivere fino all'età adulta".
Per produrre nuove proteine, le cellule trascrivono il loro DNA in RNA messaggeri (o mRNA), che forniscono le informazioni necessarie per produrre le proteine. Quando un dato mRNA ha raggiunto il suo scopo, è degradato. Il processo di degradazione è spesso guidato da minuscole sequenze di RNA chiamate microRNA.
In un lavoro precedente, i ricercatori hanno dimostrato che alcuni trascritti di mRNA o RNA non codificanti, anziché essere degradati dai microRNA, possono invece ribaltare la situazione sui microRNA e portare alla loro distruzione attraverso un percorso chiamato degradazione del microRNA mirata o TDMD. "Questo percorso porta a un rapido ricambio di alcuni microRNA all'interno della cellula", afferma Elena Kingston, ex studentessa laureata di Bartel Lab.
Kingston voleva comprendere ulteriormente le funzioni del percorso TDMD nelle cellule. "Volevo arrivare al 'perché'", ha detto. "Perché i microRNA sono regolati in questo modo e perché è importante in un organismo?"
Il lavoro precedente sul percorso TDMD è stato condotto principalmente in cellule in coltura. Per il nuovo studio, i ricercatori hanno deciso di utilizzare il moscerino della frutta Drosophila melanogaster. Un modello di mosca potrebbe fornire maggiori informazioni su come il percorso ha funzionato in un organismo vivo, incluso se ha avuto o meno un effetto sulla forma fisica dell'organismo o è stato essenziale per la sopravvivenza.
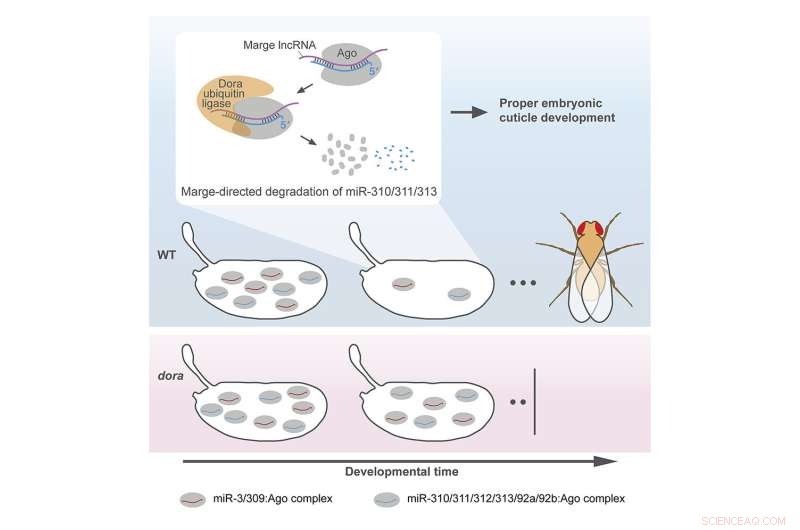
I ricercatori hanno creato un modello per studiare il TDMD utilizzando mosche con mutazioni in un gene essenziale del percorso TDMD chiamato Dora (il gene umano equivalente è chiamato ZSWIM8, come dettagliato in questo articolo). Pochissime mosche con mutazioni in Dora sono state viste raggiungere l'età adulta. La maggior parte è morta all'inizio dello sviluppo, suggerendo che il percorso TDMD era probabilmente importante per la loro vitalità embrionale.
Mettere un dito sui trigger del percorso TDMD
Mentre i microRNA non necessitano di molte coppie di basi complementari per legare e regolare i loro bersagli mRNA, nel percorso TDMD è vero il contrario. Per funzionare correttamente, il percorso TDMD necessita di un trigger altamente specifico, che può essere un mRNA che codifica per proteine o un RNA non codificante. "La particolarità di un trigger è che ha un sito a cui il microRNA può legarsi che ha molta complementarità con il microRNA", ha detto Kingston.
Durante l'isolamento della prima pandemia di COVID-19, Kingston ha deciso di scrivere un programma in grado di individuare i probabili fattori scatenanti della degradazione del microRNA nella Drosophila in base alle loro sequenze. Il programma ha restituito migliaia di risultati e i ricercatori si sono messi al lavoro per restringere i siti che erano i migliori candidati per testare le mosche.
"Non appena siamo stati in grado di tornare in laboratorio [dopo il blocco], ho preso i nostri 10 migliori candidati e ho provato a disturbarli con le mosche", ha detto. "Fortunatamente per me, circa la metà di loro ha finito per lavorare."
Questi sei nuovi trigger sono più del doppio dell'elenco delle sequenze di RNA conosciute che possono dirigere la degradazione dei microRNA. Per portare questa scoperta un ulteriore passo avanti, i ricercatori hanno condotto un'analisi di cosa è successo alle mosche quando un trigger è stato interrotto.
I ricercatori hanno scoperto che uno dei fattori scatenanti, un lungo RNA non codificante, gioca un ruolo nel corretto sviluppo della cuticola o del guscio esterno impermeabile di un embrione di mosca. "Abbiamo notato che quando abbiamo perturbato questo innesco, le cuticole degli embrioni di mosca avevano un'elasticità alterata", ha detto Kingston. "Quando abbiamo estratto gli embrioni dai loro gusci d'uovo, abbiamo potuto vedere queste cuticole espandersi e gonfiarsi".
A causa del fenotipo gonfio, Kingston ha deciso di chiamare il lungo margine di RNA non codificante dopo la zia Marge, un personaggio della serie di Harry Potter. In "Harry Potter e il prigioniero di Azkaban", le provocazioni di zia Marge portano Harry a eseguire accidentalmente magie su di lei, facendola gonfiare e fluttuare via.
In futuro, Kingston, che da allora si è laureato e ha iniziato una carriera nel settore delle biotecnologie, spera che i ricercatori raccolgano la torcia sull'apprendimento dei ruoli di altri fattori scatenanti TDMD. "Abbiamo ancora molti altri fattori scatenanti [da questo documento] in cui non esiste un ruolo biologico noto per loro al volo", ha detto. "Penso che questo apra il campo agli altri per entrare e porre le domande:'Dove agiscono questi fattori scatenanti? Cosa stanno facendo? E qual è il fenotipo quando li perdi?'" + Esplora ulteriormente