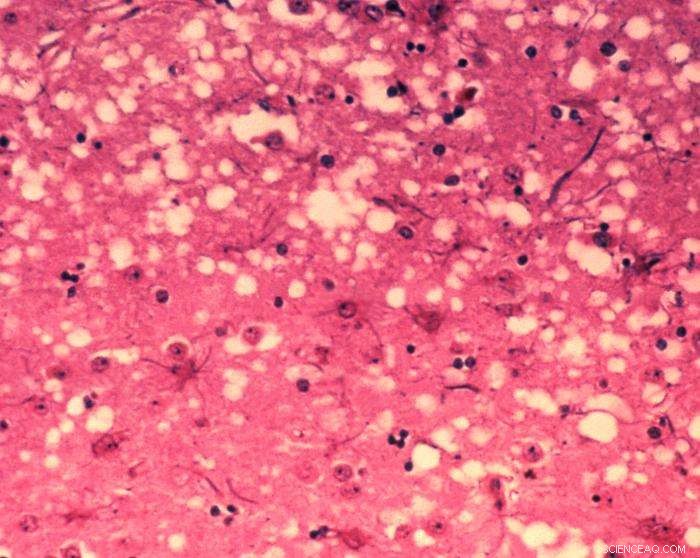
Questa micrografia del tessuto cerebrale rivela i cambiamenti istopatologici citoarchitettonici riscontrati nell'encefalopatia spongiforme bovina. La presenza di vacuoli, cioè microscopici "buchi" nella materia grigia, conferisce al cervello delle vacche affette da BSE un aspetto spugnoso quando le sezioni di tessuto vengono esaminate in laboratorio. Credito:Dr. Al Jenny - Public Health Image Library, APHIS:pubblico dominio
In un nuovo studio, i ricercatori della Case Western Reserve University School of Medicine hanno identificato la struttura delle fibrille proteiche legate a una forma ereditaria di malattia da prioni umani. Questa intuizione, dicono, rivela il meccanismo di come i prioni possono saltare tra alcune specie animali, pur mantenendo una barriera di trasmissibilità tra altre specie.
Sebbene le loro scoperte non abbiano implicazioni immediate per lo sviluppo di nuove terapie per i disturbi da prioni umani più comuni come la malattia di Creutzfeldt-Jakob, il lavoro suggerisce che il potenziale per la trasmissione della malattia da una specie all'altra può essere previsto sulla base di informazioni strutturali.
"Una delle principali domande rimaste nel campo delle malattie da prioni è stata il motivo per cui queste malattie sono trasmissibili tra alcune specie animali ma non altre", ha affermato Witold Surewicz, professore presso il Dipartimento di Fisiologia e Biofisica della Scuola di Medicina e il autore senior. "I nostri risultati spiegano come funziona."
Lo studio è stato pubblicato su Nature Structural &Molecular Biology . Qiuye Li, un borsista post-dottorato presso la School of Medicine, era l'autore principale. Lo studio è stato co-autore dello studio Christopher Jaroniec, professore di chimica e biochimica presso la Ohio State University.
Le malattie da prioni, note anche come "encefalopatie spongiformi trasmissibili", sono un gruppo di disturbi infettivi di deperimento cerebrale che includono, tra gli altri, la malattia di Creuzfeldt-Jakob nell'uomo, l'encefalopatia spongiforme bovina (morbo della mucca pazza) nei bovini e la malattia da deperimento cronico nei cervi e alci.
Questi disordini fatali sono unici a causa del loro agente patogeno infettivo, che non è un virus ma una forma anormale della proteina prionica.
Questa proteina deformata si assembla in lunghe fibrille che si diffondono agendo come un modello, o "seme", che si lega alla normale proteina prionica e la costringe a cambiare forma in una forma anormale che causa malattie, ha detto Surewicz.
Mentre le proteine di forma anormale possono agire prontamente come modelli per convertire le normali proteine prioni dalla stessa specie, si ritiene che la semina incrociata sia limitata a causa delle differenze specie-dipendenti nella sequenza degli amminoacidi, i mattoni di base di ciascuna proteina.
"Sembra che le barriere, o la loro mancanza, siano completamente dettate dalla capacità delle proteine prioniche di una specie di adottare la struttura dei semi di fibrille prioniche di un'altra specie", ha detto Li. "Questo, a sua volta, dipende dalle differenze di amminoacidi nelle posizioni chiave che determinano la struttura."
In precedenza, gli scienziati del laboratorio di Surewicz hanno sviluppato un modello che utilizzava una forma tronca di proteine prioniche che permetteva loro di studiare in provetta i meccanismi di propagazione dei prioni, compreso il fenomeno delle barriere di trasmissibilità (semina).
Tuttavia, la piena comprensione di questi meccanismi è stata ostacolata dalla mancanza di informazioni sulla struttura delle fibrille infettive formate da queste proteine.
Gli autori hanno superato questo limite fondamentale attraverso l'uso di una tecnica di microscopia crioelettronica, un tipo di microscopia in cui le immagini vengono raccolte a temperature molto basse.
Analizzando al computer migliaia di immagini di fibrille formate da proteine di prioni modello umano e murino, hanno determinato l'architettura di queste fibrille con una risoluzione vicina ai singoli atomi. Questa intuizione strutturale ha permesso ai ricercatori di spiegare, in termini strutturali precisi, perché esistono barriere di trasmissibilità dei prioni tra alcune specie mentre non si osservano tali barriere tra altre specie.
"Anche se i nostri studi attuali sono stati condotti utilizzando un sistema modello", ha affermato Surewicz, "la capacità di razionalizzare e prevedere le barriere di trasmissibilità dei prioni sulla base di dati strutturali ha importanti implicazioni pratiche, soprattutto data l'attuale epidemia di malattie da deperimento cronico tra alci e cervi in alcune parti degli Stati Uniti e del Canada e crescenti preoccupazioni sulla potenziale trasmissione di questa malattia agli esseri umani". + Esplora ulteriormente