Credito:Università di Colonia
Un nuovo studio mostra che la proteina CHIP può regolare il recettore dell'insulina in modo più efficiente da sola che in uno stato accoppiato. In situazioni di stress cellulare, il CHIP di solito appare come un omodimero, un'associazione di due proteine identiche, e serve principalmente a degradare le proteine mal ripiegate e difettose. CHIP pulisce così la cellula. A tal fine, CHIP collabora con le proteine helper per attaccare una catena della piccola proteina ubiquitina alle proteine mal ripiegate. Le proteine difettose vengono così riconosciute ed eliminate dalla cellula. Inoltre, il CHIP regola anche la trasduzione del segnale del recettore dell'insulina. CHIP lega l'ubiquitina al recettore per degradarlo e fermare l'attivazione dei prodotti genici che allungano la vita.
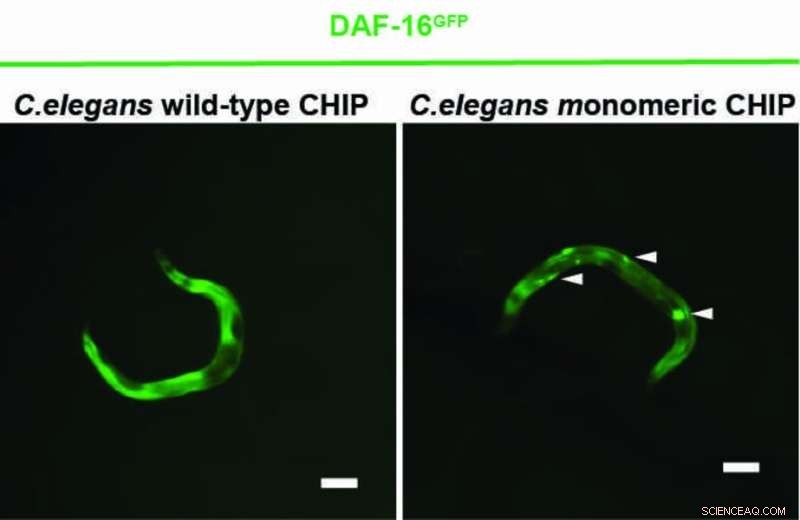
Un gruppo di ricerca con sede a Colonia guidato dal Prof. Dr. Thorsten Hoppe ha ora dimostrato in esperimenti con il nematode Caenorhabditis elegans e cellule umane che il CHIP può anche etichettarsi con l'ubiquitina, che ne impedisce la formazione di dimeri. Il monomero CHIP è più efficiente del dimero CHIP nella regolazione della segnalazione dell'insulina. Lo studio del Cluster of Excellence for Cellular Stress Responses in Aging-Associated Diseases (CECAD) dell'Università di Colonia è stato pubblicato su Molecular Cell sotto il titolo "Un interruttore dimmer-monomero controlla l'ubiquitilazione e l'elaborazione del substrato dipendenti dal CHIP".
"Il fatto che il CHIP funzioni da solo o in coppia dipende dallo stato della cellula. Sotto stress, ci sono troppe proteine mal ripiegate e le proteine aiutanti che si legano al CHIP e prevengono l'auto-ubiquitilazione, l'autoetichettatura con l'ubiquitina", ha detto Vishnu Balaji, primo autore dello studio.
"Dopo che il CHIP ha ripulito con successo le proteine difettose, può anche contrassegnare le proteine aiutanti per la degradazione. Ciò consente al CHIP di ubiquitarsi e funzionare di nuovo come monomero", ha spiegato. Pertanto, affinché il corpo funzioni senza intoppi, deve esserci un equilibrio tra gli stati monomerico e dimerico di CHIP.
"È interessante notare che l'equilibrio monomero-dimero del CHIP sembra essere interrotto nelle malattie neurodegenerative", ha affermato Thorsten Hoppe. "Nelle atassie spinocerebellari, ad esempio, diversi siti di CHIP sono mutati e funziona principalmente come un dimero. Qui, un passaggio a più monomeri sarebbe un possibile approccio terapeutico".
Nella fase successiva, gli scienziati vogliono scoprire se ci sono altre proteine o recettori a cui si lega il monomero CHIP e quindi ne regola la funzione. I ricercatori sono anche interessati a scoprire in quali tessuti e organi e in quali malattie si verificano in maggior numero i monomeri o dimeri CHIP, per poter sviluppare in futuro terapie più mirate. + Esplora ulteriormente