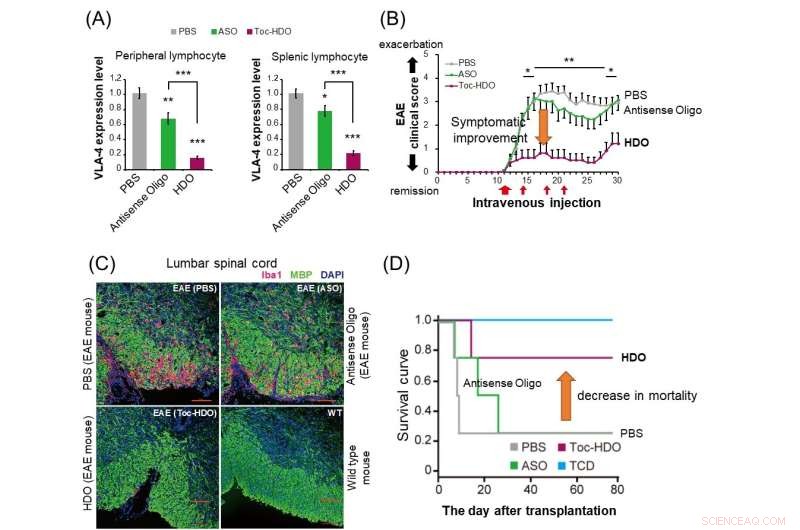
(A) Nei topi normali, la somministrazione di HDO (barra rossa) sopprime più drasticamente l'espressione del gene dell'integrina α4β1 nei linfociti periferici e splenici rispetto all'oligonucleotide antisenso (barra verde). (B) Nei topi sperimentali con encefalomielite autoimmune (EAE), la somministrazione di HDO mirata all'integrina α4β1 dopo l'insorgenza dei sintomi ha mostrato un miglioramento del punteggio clinico. (C) La somministrazione di HDO mirata all'integrina α4β1 prima dell'inizio dei topi EAE provoca una ridotta infiltrazione di cellule infiammatorie Iba1-positive (rosso) e una migliore demielinizzazione (verde) nel midollo spinale lombare. (D) Nel modello murino di trapianto contro -malattia dell'ospite (GVHD), il trapianto di cellule T derivate dalla milza insieme a cellule del midollo osseo dopo il trattamento con HDO mirato all'integrina α4β1 ha migliorato la curva di sopravvivenza. TCD:cellule del midollo osseo trapiantate senza cellule T derivate dalla milza. Credito:Dipartimento di Neurologia e Scienze Neurologiche, TMDU
I linfociti T e B, che fanno parte di un gruppo di cellule immunitarie comunemente chiamate globuli bianchi, lavorano insieme per eliminare gli invasori estranei nel corpo come i virus. Tuttavia, alcune malattie possono insorgere quando i linfociti T e B vengono attivati in momenti inappropriati, inclusi disturbi autoimmuni e vari tipi di cancro. In un recente articolo pubblicato su Nature Communications , un team guidato da ricercatori della Tokyo Medical and Dental University (TMDU) descrive una tecnologia chiamata oligonucleotide eteroduplex (HDO) che hanno sviluppato per fornire ai linfociti e regolarne le funzioni.
L'espressione genica è alla base del controllo dell'attività cellulare. La malattia può verificarsi quando alcuni geni sono disattivati in modo improprio o sono espressi in modo incontrollabile. Pertanto, gli scienziati hanno mirato a sviluppare metodi terapeutici per riportare i livelli di espressione genica al loro stato di salute, idealmente solo nelle cellule anormali. Una di queste modalità consiste nel fornire molecole di DNA o RNA specificamente ingegnerizzate in grado di localizzare i messaggi genici misexpressed e dirigere la cellula per riportarli a livelli normali. Tuttavia, la parte più difficile di questo è garantire che le molecole terapeutiche possano raggiungere in modo efficiente la loro corretta destinazione senza essere degradate dalla cellula.
"Il nostro team ha progettato una molecola ibrida DNA/RNA chiamata HDO", afferma l'autore principale dello studio Masaki Ohyagi. "La sequenza specifica dell'HDO può essere modificata per colpire un particolare gene di interesse, mentre la sua spina dorsale lo rende stabile all'interno delle cellule".
Una parte fondamentale del progetto HDO del team è l'aggiunta di una molecola chiamata α-tocoferolo, che è fondamentale per la sua corretta somministrazione. Poiché l'α-tocoferolo è essenziale per una corretta risposta immunitaria linfocitaria, l'aggiunta di ciò consente all'HDO di essere erogato all'interno del sangue periferico e diretto ai linfociti. Il team ha progettato HDO per diversi geni murini e poi li ha iniettati per via endovenosa nei topi di laboratorio.
"Abbiamo scoperto che la nostra tecnologia HDO è stata in grado di silenziare in modo specifico questi geni nei linfociti del topo in modo più robusto e stabile, e anche con meno tossicità, rispetto ad altre versioni precedenti di questo metodo", afferma Takanori Yokota, autore senior dell'articolo. "I nostri studi hanno anche dimostrato che gli HDO entrano in queste cellule attraverso un processo chiamato endocitosi".
Dopo aver scoperto che la loro tecnologia era efficace nel silenziamento genico, il team TMDU ha studiato se potesse essere utile come trattamento della malattia. Hanno progettato un HDO mirato a un gene chiamato Itga4, che è fondamentale per la patogenesi dell'encefalomielite autoimmune sperimentale (EAE), un modello murino per la sclerosi multipla (SM).
"L'iniezione endovenosa di questi topi con un HDO mirato a Itga4 ha ritardato l'insorgenza e migliorato i sintomi dell'EAE e ridotto sia l'infiltrazione delle cellule infiammatorie che la demielinizzazione del midollo spinale", spiega Ohyagi.
Questo lavoro dimostra i potenti effetti di silenziamento genico della tecnologia HDO, nonché le sue capacità di consegna superiori rispetto ad altri metodi simili. Più significativamente, l'HDO specifico di Itga4 è stato in grado di migliorare i risultati in un modello murino di SM, suggerendo che potrebbe essere utile come una nuova terapia che potrebbe essere sviluppata per le malattie immuno-mediate umane.