Un gruppo di ricerca congiunto guidato dal dottor Akira Kunitomi, ex borsista post-dottorato presso il CiRA (attualmente ricercatore presso il Gladstone Institute of Cardiovascolare Disease) e ID Pharma Co., Ltd., ha scoperto il ruolo cruciale dell'istone linker specifico dell'ovocita , H1FOO, nel migliorare l'efficienza e l'omogeneità della riprogrammazione negli stati pluripotenti innescati e ingenui. Lo studio è pubblicato in Stem Cell Reports .
Mentre la riprogrammazione convenzionale produce cellule staminali pluripotenti indotte umane (iPS) con caratteristiche "preparate", simili a epiblasti post-impianto con un potenziale limitato di trasformarsi in tessuti extraembrionali, lo stato pluripotente "ingenuo" mostra proprietà più simili alle cellule epiblasto preimpianto e alle cellule iPS di topo , consentendo loro di differenziarsi sia in linee embrionali che extraembrionali.
Anche se le cellule iPS umane innescate e naïve hanno consentito progressi biomedici precedentemente inimmaginabili, una delle sfide principali che riguardano le cellule iPS per la ricerca di base e per scopi medici è la loro eterogeneità. I metodi di riprogrammazione tradizionali rimangono un processo stocastico e, quindi, molti ricercatori continuano a cercare mezzi più efficienti e precisi per generare cellule iPS omogenee.
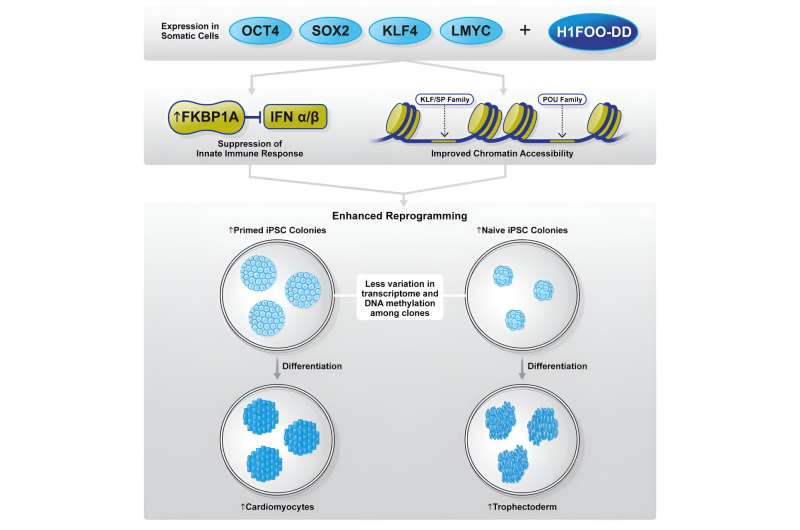
Nel loro recente studio, il gruppo di ricerca collaborativo ha esaminato il potenziale dell’istone H1FOO del linker specifico per la madre come fattore candidato per perfezionare il processo di riprogrammazione. I ricercatori hanno progettato H1FOO collegando un dominio di destabilizzazione (DD) in modo da poter manipolare chimicamente la sua degradazione e regolarne attentamente i livelli.
Se utilizzato in combinazione con i fattori Yamanaka (OSKL, MYC è stato sostituito da LMYC per evitare la tumorigenesi), hanno scoperto che H1FOO-DD migliora significativamente l'efficienza della generazione di cellule iPS, indipendentemente dal sistema di consegna del gene utilizzato.
Sebbene l'espressione genica e le analisi epigenetiche non abbiano identificato alcuna differenza significativa tra la riprogrammazione utilizzando solo OSKL o in combinazione con H1FOO-DD, hanno tuttavia rivelato che utilizzando H1FOO-DD, le cellule iPS generate in modo indipendente mostravano un modello di espressione genica più simile , indicando così miglioramenti in termini di omogeneità e riproducibilità.
In particolare, un'analisi di geni con espressione altamente variabile tra linee cellulari iPS indipendenti ha suggerito che H1FOO riduceva tale variabilità di quasi la metà. Fondamentalmente, molti di questi geni sono coinvolti nella regolazione dell'espressione genica, dimostrando quindi la capacità di H1FOO-DD di guidare il processo di riprogrammazione in modo più rigoroso.
Inoltre, i ricercatori hanno anche osservato che le cellule iPS generate tramite riprogrammazione con H1FOO-DD erano migliori nel differenziarsi in endoderma, uno dei tre strati germinali primari, e cardiomiociti (un tipo di cellula mesodermica).
Il gruppo di ricerca ha continuato la propria indagine esaminando i meccanismi sottostanti attraverso i quali H1FOO-DD migliora la riprogrammazione. Mediante l'analisi del sequenziamento dell'RNA a cellula singola (scRNA-seq), i ricercatori hanno scoperto che la riprogrammazione con H1FOO-DD non solo ha portato a un'espressione più precoce e più elevata di geni legati alla pluripotenza, ma ha anche soppresso l'espressione di geni legati alla risposta immunitaria innata, all'infiammazione e alla apoptosi (morte cellulare programmata).
In particolare, H1FOO-DD ha aumentato la percentuale di cellule classificate come riprogrammate con successo, riducendo al contempo le sottopopolazioni cellulari ritenute aver subito una riprogrammazione incompleta o non riuscita.
Dato il ruolo di H1FOO come fattore di rimodellamento della cromatina, i ricercatori hanno anche esaminato l'accessibilità alle regioni della cromatina. Coerentemente con i risultati dell'analisi dell'espressione genica, le regioni della cromatina, in particolare quelle vicine ai marcatori di pluripotenza, si aprivano prima ed erano più accessibili quando H1FOO-DD veniva incluso come fattore di riprogrammazione.
Ulteriori analisi hanno dimostrato che le famiglie di fattori di trascrizione POU e KLF/SP sono state attivate in precedenza durante il processo di riprogrammazione da parte di H1FOO-DD. Questi risultati suggeriscono che H1FOO-DD aiuta a coordinare la riprogrammazione in modo più efficiente e tempestivo per migliorare la generazione di cellule iPS.
I ricercatori si sono poi concentrati sugli effettori a valle che aiutano a mediare gli effetti positivi di H1FOO-DD sulla generazione di cellule iPS esaminando i geni con espressione differenziale nelle prime fasi della riprogrammazione. Attraverso questa analisi, hanno identificato 19 geni sovraregolati e due sottoregolati quando H1FOO-DD è stato incluso come fattore di riprogrammazione.
Il gruppo di ricerca ha esaminato questi geni individualmente per determinare se influenzano la riprogrammazione innescata e naïve e ha scoperto che la sovraespressione di FKBP1A o APOE migliora la riprogrammazione. Poiché in precedenza era stato segnalato che l'APOE era altamente espresso durante la riprogrammazione, i ricercatori hanno concentrato la loro attenzione sull'FKBP1A nella speranza di rivelare nuovi meccanismi molecolari alla base della riprogrammazione riuscita.
In particolare, hanno scoperto che mentre la riprogrammazione utilizzando solo OSKL aumenta l'espressione di FKBP1A, l'inclusione di H1FOO-DD la migliora notevolmente. Questa osservazione è stata ulteriormente supportata dal riesame dei dati sull'espressione genica e sull'accessibilità della cromatina che avevano già raccolto.
FKBP1A è un'immunofilina coinvolta nell'immunosoppressione che può interagire e inibire il TGFBR1, che, a sua volta, promuove la transizione mesenchimale-epiteliale (MET) e migliora l'efficienza della riprogrammazione.
I ricercatori hanno quindi ipotizzato che entrambe le funzioni di FKBP1A (nel sopprimere l'immunità innata e nell'inibire il MET mediato da TGFBR1) siano probabilmente responsabili del miglioramento dell'efficienza della riprogrammazione da parte di H1FOO-DD.
In particolare, hanno scoperto che la riprogrammazione tramite una combinazione di sovraespressione di OSKL e FKBP1A ha portato a una soppressione di TGFBR1, un potenziamento di MET, una soppressione della risposta immunitaria innata e un'apoptosi comparabili, come quando H1FOO-DD è stato utilizzato per avviare la riprogrammazione.
Infine, poiché le precedenti analisi dell'espressione genica hanno indicato che oltre a migliorare la riprogrammazione innescata, H1FOO-DD ha anche indotto l'espressione di marcatori dello stato naïve, i ricercatori hanno esaminato se H1FOO-DD è anche in grado di promuovere la riprogrammazione allo stato naïve. Infatti, hanno osservato che l'inclusione di H1FOO-DD migliora sostanzialmente la generazione di cellule iPS naïve.
Inoltre, analogamente alla riprogrammazione innescata, H1FOO-DD ha rafforzato il processo di riprogrammazione coordinando una regolazione genica ed epigenetica più uniforme nelle cellule. Funzionalmente, come misurato dall'attività metabolica e dalla riattivazione del cromosoma X, la riprogrammazione utilizzando H1FOO-DD ha prodotto cellule iPS naïve più simili alle cellule staminali embrionali naïve o alle blastocisti preimpianto rispetto a quando OSKL è stato utilizzato da solo.
In sintesi, gli sforzi congiunti del team di ricerca congiunto hanno identificato l’asse H1FOO-FKBP1A come mezzo per riprogrammare le cellule con maggiore efficienza e precisione. Questi risultati dimostreranno di avere un impatto enorme sulla generazione di cellule iPS sia per la ricerca scientifica di base che per le applicazioni cliniche.
Ulteriori informazioni: Akira Kunitomi et al, H1FOO-DD promuove l'efficienza e l'uniformità nella riprogrammazione verso la pluripotenza ingenua, Report sulle cellule staminali (2024). DOI:10.1016/j.stemcr.2024.04.005
Informazioni sul giornale: Rapporti sulle cellule staminali
Fornito dall'Università di Kyoto