Mantenere intatte le informazioni genetiche immagazzinate nel DNA genomico durante il ciclo di divisione cellulare è fondamentale per quasi tutte le forme di vita. Un danno estensivo al DNA provoca invariabilmente vari riarrangiamenti genomici avversi, che possono portare alla morte cellulare nei casi migliori e all'insorgenza di malattie come il cancro nei casi peggiori.
Fortunatamente, le cellule di tutti e tre i domini della vita condividono un peculiare meccanismo privo di errori per il mantenimento delle informazioni genetiche, noto come ricombinazione omologa (HR).
Il processo di HR inizia quando una cellula incontra un danno al DNA durante la sintesi del DNA o successivamente, dando inizio a una cascata di eventi. Il DNA danneggiato viene prima resecato o tagliato per creare estremità a filamento singolo vicino al sito danneggiato. Queste estremità vengono quindi abbinate alla regione corrispondente in un cromosoma replicato disponibile, noto anche come "cromatide fratello", che viene essenzialmente utilizzato come modello per riparare il DNA danneggiato.
Come ci si potrebbe aspettare, il percorso HR coinvolge una miriade di proteine e macchinari cellulari. Sebbene la maggior parte di queste proteine e macchinari cellulari siano ben studiati, alcuni di essi rimangono alquanto enigmatici. È il caso dei regolatori di RAD51, una proteina responsabile della riparazione delle rotture del doppio filamento del DNA.
Normalmente, RAD51 forma filamenti che aiutano a preservare le forcelle di replicazione del DNA:disposizioni transitorie del DNA che spesso si verificano durante la replicazione del DNA, come nel collasso delle forche di replicazione. Una corretta regolamentazione del RAD51, così come il degrado di questi filamenti una volta esaurito il loro scopo, è essenziale per le risorse umane.
Tuttavia, i meccanismi precisi attraverso i quali l'accumulo anomalo di RAD51 porta all'instabilità genetica non sono completamente compresi e molti regolatori positivi e negativi di RAD51 rimangono oscuri.
Ora, però, in un recente articolo pubblicato su Nucleic Acid Research il 10 aprile 2024, un gruppo di ricerca guidato dal professor Miki Shinoara del Dipartimento di Bioscienze Avanzate, Università di Kindai, Giappone, ha studiato la stretta relazione tra RAD51 e FIGNL1, uno dei suoi principali regolatori. Lo studio è stato scritto da Kenichiro Matsuzaki, anche lui del Dipartimento di Bioscienze Avanzate dell'Università di Kindai, e getta la luce tanto necessaria sulle complessità del processo delle risorse umane.
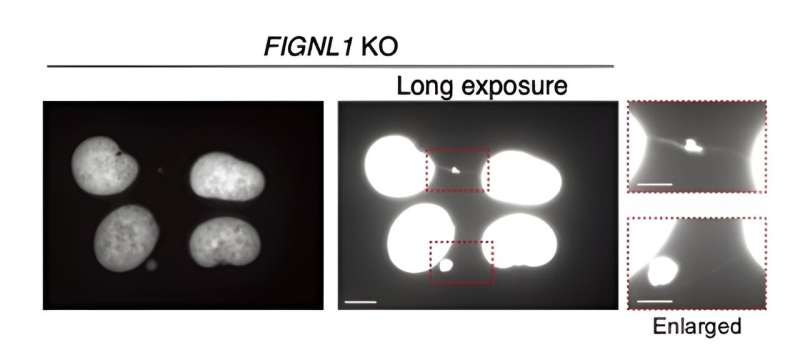
In primo luogo, i ricercatori hanno ingegnerizzato geneticamente cellule umane che non esprimevano FIGNL1 (ovvero cellule FIGNL1 KO), utilizzando il metodo CRISPR/Cas9 ormai consolidato. Quindi, utilizzando tecniche avanzate di immunocolorazione che coinvolgono anticorpi accuratamente selezionati e microscopia a fluorescenza, hanno visualizzato il processo HR in dettaglio, cercando indicatori di anomalie.
Combinando questo approccio con una serie di altre procedure sperimentali, come il western blotting, l'analisi del ciclo cellulare, i saggi proteici e le analisi genomiche e trascrittomiche, sono riusciti a ottenere un quadro completo di ciò che accade in una cellula quando manca FIGNL1.
I risultati rivelano che FIGNL1 è un enzima di smantellamento del RAD51 altamente specializzato, necessario per una corretta separazione dei cromosomi dopo che le forcelle di replicazione sono state "smontate".
Più specificamente, quando i filamenti RAD51 non sono completamente smantellati, durante la mitosi si verificano eventi anomali che producono intermedi irrisolti. Ciò porta alla fine alla formazione dei cosiddetti "ponti cromosomici" tra i cromatidi fratelli. Queste strutture ultrasottili sono molto dannose per il normale funzionamento della cellula, causando la propagazione di informazioni genetiche catastrofiche.
Comprendere i dettagli più fini del percorso delle risorse umane, i suoi attori chiave e i suoi numerosi sottoprocessi è estremamente importante non solo dal punto di vista biologico, ma anche dal punto di vista medico.
"La morte cellulare dovuta alla disregolazione dell'HR è un meccanismo importante attraverso il quale i farmaci antitumorali mostrano una citotossicità specifica per le cellule tumorali", spiega il Prof. Shinohara. "Fino ad ora, l'obiettivo principale era il deficit di attivazione delle HR, ma i risultati di questo studio mostrano che l'attivazione persistente di RAD51 presenta anche citotossicità e può essere un bersaglio molecolare per i farmaci antitumorali."
Inoltre, il meccanismo cellulare coinvolto nel percorso HR può essere sfruttato come potente strumento di bioingegneria.
"L'HR è un sistema ben conservato nella maggior parte delle specie ed è anche strettamente connesso alle tecnologie di modificazione genetica, come l'editing del genoma e le tecnologie di targeting genetico", commenta il prof. Shinohara, "Quindi, chiariamo i meccanismi che controllano l'attività della ricombinasi, come quella di RAD51, può contribuire ad aumentare l'efficienza delle tecniche di modificazione genetica."
Vale la pena notare che l'ingegneria genetica è una strada molto efficace per aumentare la resa dei raccolti e per personalizzare gli organismi microbici per compiti come il biorisanamento, che affronta vari problemi del mondo moderno.
Nel complesso, i risultati di questo studio non solo fanno luce su un processo biologico universale, ma aprono anche la strada verso una migliore comprensione dei meccanismi cellulari per importanti scoperte farmaceutiche e progressi nel campo dell'ingegneria genetica.
Ulteriori informazioni: Kenichiro Matsuzaki et al, AAA+ ATPasi umana FIGNL1 sopprime la formazione di ponti ultrafini mediata da RAD51, Ricerca sugli acidi nucleici (2024). DOI:10.1093/nar/gkae263
Informazioni sul giornale: Ricerca sugli acidi nucleici , Ricerca sugli acidi nucleici
Fornito dall'Università Kindai