Niente vive per sempre, ma rispetto ad altre cellule del corpo, le cellule staminali emopoietiche (HSC) hanno una vita straordinariamente lunga. Le HSC sono cellule che formano il sangue:danno origine a cellule progenitrici che si dividono rapidamente, che a loro volta generano centinaia di miliardi di cellule per soddisfare la domanda giornaliera di globuli rossi che forniscono ossigeno, globuli bianchi che combattono le malattie e piastrine che formano coaguli.
Le HSC tipicamente rimangono dormienti nel midollo osseo, ma possiedono la capacità di attivare e ricostituire continuamente le cellule del sangue, mantenendo un profilo relativamente giovane per tutta la vita di un organismo. Qual è il segreto delle HSC a vita lunga che scongiurano gli effetti dell’invecchiamento? Un team guidato da ricercatori del Baylor College of Medicine lo ha rivelato in Nature Cell Biology che l'enzima ciclofilina A, prodotto in grandi quantità nelle HSC, è fondamentale affinché queste cellule mantengano il loro potenziale rigenerativo e prevengano gli effetti dell'invecchiamento.
"Una forza trainante dell'invecchiamento cellulare è l'accumulo di proteine che hanno raggiunto la fine della loro vita utile", ha detto l'autore corrispondente Dr. André Catic, professore assistente e studioso CPRIT in ricerca sul cancro presso l'Huffington Center on Aging a Baylor. "Con l'età, le proteine tendono a ripiegarsi male, ad aggregarsi e ad accumularsi all'interno della cellula, il che porta a uno stress tossico che può interrompere la funzione cellulare."
Le cellule che frequentemente partecipano alla divisione cellulare, come le cellule progenitrici, possono smaltire gli aggregati proteici attraverso la diluizione. D'altra parte, le HSC a vita lunga, che non si dividono spesso, affrontano il problema dell'accumulo di proteine mal ripiegate e del conseguente stress tossico. Tuttavia, le HSC rimangono impermeabili all’invecchiamento. Come lo fanno?
"La comprensione dei meccanismi molecolari che contribuiscono all'invecchiamento delle HSC non solo contribuisce al campo della normale biologia delle HSC, ma può anche avere una rilevanza clinica significativa per il trattamento del cancro", ha affermato la co-autrice del lavoro, la Dott.ssa Lauren Maneix, che era al il laboratorio Catic mentre lavoravo a questo progetto.
Precedenti studi hanno dimostrato che le cellule dei mammiferi esprimono diverse centinaia di chaperoni molecolari, proteine che preservano o modificano la conformazione tridimensionale delle proteine esistenti. Le ciclofiline, uno degli chaperon più abbondanti, sono implicate nel processo di invecchiamento. Tuttavia, il modo in cui influenzano le proteine cellulari non è stato studiato in precedenza.
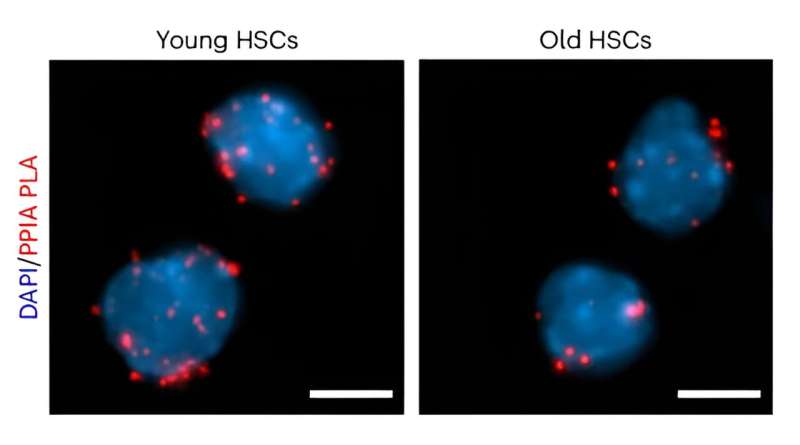
Lavorando con i topi, i ricercatori hanno prima caratterizzato il contenuto proteico delle HSC e scoperto che la ciclofilina A è uno chaperone prevalente. Ulteriori esperimenti hanno dimostrato che l'espressione della ciclofilina A era significativamente ridotta nelle HSC invecchiate e che l'eliminazione genetica della ciclofilina A ha accelerato l'invecchiamento naturale nel compartimento delle cellule staminali. Al contrario, la reintroduzione della ciclofilina A nelle HSC invecchiate ne ha migliorato la funzione. Insieme, questi risultati supportano la ciclofilina A come fattore chiave nella longevità delle HSC.
Successivamente, il team ha studiato le proteine con cui la ciclofilina A interagisce, preservandone la stabilità. "Abbiamo scoperto che le proteine arricchite in regioni intrinsecamente disordinate sono bersagli frequenti dello chaperone", ha detto Catic.
Le proteine intrinsecamente disordinate cambiano naturalmente la loro conformazione 3D per interagire con diverse proteine, acidi nucleici o altre molecole. Di conseguenza, le proteine ricche di regioni intrinsecamente disordinate regolano molti processi cellulari promuovendo attività specifiche tra le molecole.
"A causa della loro natura flessibile, le proteine intrinsecamente disordinate sono intrinsecamente inclini all'aggregazione. La ciclofilina A supporta queste proteine nell'adempimento delle loro funzioni e contemporaneamente impedisce loro di aggregarsi", ha detto Catic.
Inoltre, i risultati suggeriscono che la ciclofilina A interagisce con proteine intrinsecamente disordinate dal momento della loro sintesi. "Mentre queste proteine vengono prodotte, la ciclofilina A si assicura che mantengano le conformazioni appropriate e siano mantenute a livelli sufficienti", ha detto Catic. "L'esaurimento genetico della ciclofilina A fa sì che le cellule staminali siano tipicamente prive di proteine intrinsecamente disordinate."
"Per la prima volta, il nostro studio ha dimostrato che la produzione di proteine disordinate e il mantenimento della diversità strutturale delle proteine in una cellula svolgono un ruolo nell'invecchiamento delle HSC", ha affermato Maneix.
Co-prima autrice Polina Iakova, Charles G. Lee, Shannon E. Moree, Xuan Lu, Gandhar K. Datar, Cedric T. Hill, Eric Spooner, Jordon C. K. King, David B. Sykes, Borja Saez, Bruno Di Stefano, Xi Hanno contribuito a questo studio anche Chen, Daniela S. Krause, Ergun Sahin, Francis T. F. Tsai, Margaret A. Goodell, Bradford C. Berk e David T. Scadden.
Ulteriori informazioni: Laure Maneix et al, La ciclofilina A supporta la traduzione di proteine intrinsecamente disordinate e influisce sull'invecchiamento delle cellule staminali ematopoietiche, Nature Cell Biology (2024). DOI:10.1038/s41556-024-01387-x
Informazioni sul giornale: Biologia cellulare naturale
Fornito dal Baylor College of Medicine