I ricercatori di Yale hanno scoperto nuovi dettagli su come i batteri come l'E. coli costruiscono le loro barriere protettive, che contribuiranno allo sviluppo di nuovi antibiotici.
I batteri resistenti agli antibiotici rappresentano un problema crescente quando si tratta di combattere le infezioni. I batteri che hanno uno strato protettivo aggiuntivo sulle pareti cellulari, un tipo noto come "Gram-negativi" in riferimento al metodo di colorazione utilizzato per identificarli, sono particolarmente difficili da combattere.
I ricercatori di Yale hanno fatto progressi nella comprensione di come i batteri generano questo strato protettivo attraverso un nuovo studio che svela ulteriori sfumature e ulteriori bersagli per lo sviluppo di nuovi antibiotici.
I loro risultati sono stati pubblicati il 18 aprile negli Proceedings of the National Academy of Sciences .
Un componente fondamentale di questo strato protettivo è una molecola chiamata lipopolisaccaride (LPS). I batteri necessitano di una certa quantità di LPS; troppo o troppo poco uccide la cellula. Precedenti ricerche del laboratorio di Wei Mi, assistente professore di farmacologia presso la Yale School of Medicine, hanno rivelato come i sensori molecolari nell'Escherichia coli raggiungano il giusto equilibrio nella produzione di LPS.
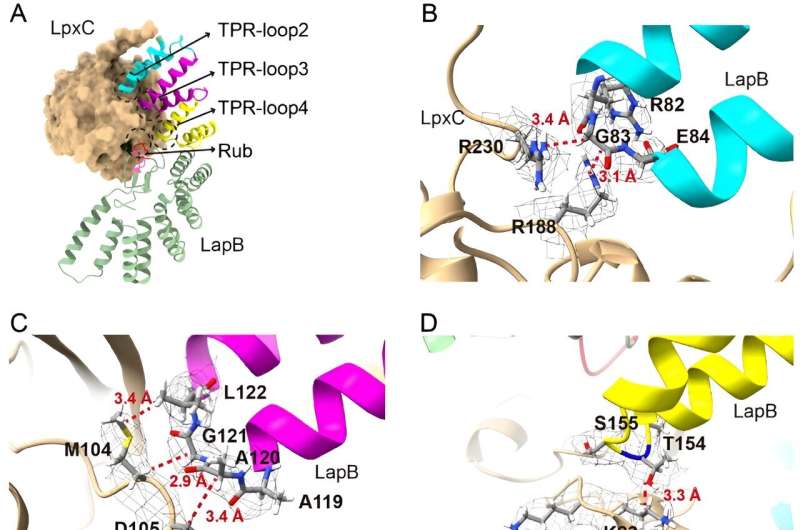
Nel nuovo studio, i ricercatori hanno approfondito la parte di questo processo che previene l’accumulo eccessivo di LPS, con l’obiettivo di chiarire come una proteina chiamata LapB si lega e stimola la degradazione di LpxC, un enzima che dà il via alla produzione di LPS. I ricercatori hanno utilizzato la microscopia elettronica criogenica per osservare la struttura del complesso creato quando queste due molecole si legano.
"Guardare la struttura fornisce la visualizzazione più diretta di come avviene questa parte del processo", ha detto Mi, autore senior del nuovo studio. "Una volta vista la struttura, abbiamo apportato modifiche alle molecole per vedere come questo influenzava il legame, il che ci ha permesso di identificare quali componenti sono necessari affinché LapB riconosca LpxC."
Ma i ricercatori hanno scoperto, con loro sorpresa, che LapB aveva anche un secondo ruolo. Non solo è responsabile della degradazione di LpxC, ma inibisce anche l'azione dell'enzima prima che avvenga la degradazione.
"Fondamentalmente, LapB spegne LpxC prima di distruggerlo", ha detto Mi. "Non capiamo perché i batteri facciano questo, poiché sembra ridondante, ma questo è ciò che stiamo esaminando ora."
I ricercatori ipotizzano che questo duplice ruolo potrebbe riguardare la flessibilità. La degradazione è un processo lento ma irreversibile, mentre l’inibizione è rapida e reversibile. Avere entrambe le capacità potrebbe consentire ai batteri di rispondere ai cambiamenti ambientali in modo più agile.
"Tutto questo è rilevante per lo sviluppo di antibiotici", ha detto Mi. "Questi dettagli ci aiuteranno a trovare nuovi approcci e a capire perché altri non funzionano."
Ulteriori informazioni: Sheng Shu et al, Doppia funzione di LapB (YciM) nella regolazione della sintesi di lipopolisaccaridi di Escherichia coli, Atti dell'Accademia Nazionale delle Scienze (2024). DOI:10.1073/pnas.2321510121
Informazioni sul giornale: Atti dell'Accademia Nazionale delle Scienze
Fornito dall'Università di Yale