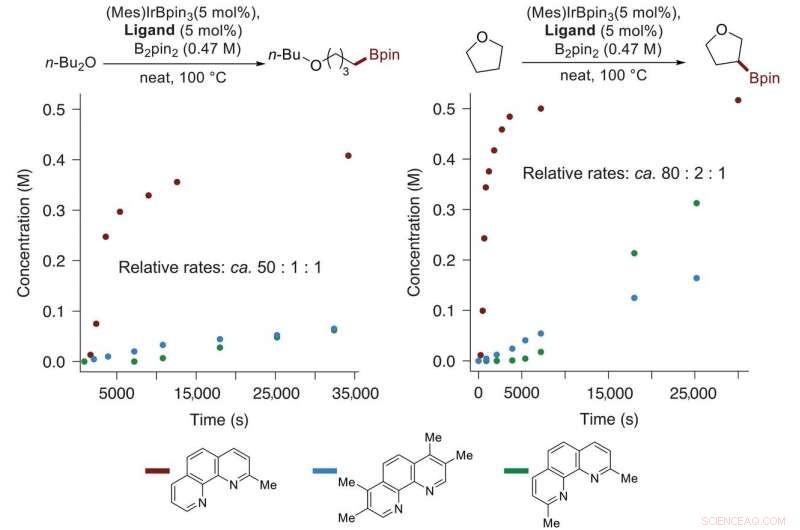
Profili delle reazioni catalizzate da Ir di THF e dibutil etere con B 2 spillo 2 con fenantroline variamente sostituite come leganti. Le reazioni sono catalizzate dalla combinazione di 5 moli % [Ir(mesitilene)(Bpin) 3 ] e 5 mol % 2-mphen (rosso), tmphen (blu), o 2, 9-dmphen (verde). I tassi relativi sono stati stimati dalla pendenza delle curve per i tassi iniziali delle reazioni con 2-mphen (rosso) rispetto a quelli per le reazioni con gli altri due ligandi dopo il periodo di induzione. n-Bu 2 Oh, n-dibutil etere; Me, metile. Credito: Scienza (2020). DOI:10.1126/science.aba6146
Un team di ricercatori dell'Università della California, Berkeley, ha scoperto che la 2-metilfenantrolina può essere utilizzata con l'iridio per accelerare le reazioni di borilazione catalitica. Nel loro articolo pubblicato sulla rivista Scienza , il gruppo descrive il loro nuovo approccio e i modi in cui potrebbe rivelarsi utile.
La borilazione catalitica è un tipo di reazione che può essere utilizzata per mirare a legami più forti saturi carbonio-idrogeno (C–H) su legami più deboli. Sfortunatamente, ad oggi, coloro che hanno tentato di utilizzare tali reazioni hanno scoperto che sono lente e utilizzano troppo dell'idrocarburo. In questo nuovo sforzo, i ricercatori hanno affrontato e superato entrambi i problemi.
Come notano i ricercatori, con reazioni di funzionalizzazione C–H, il reagente utilizzato attacca tipicamente il legame carbonioso più debole (quello con più elettroni). La nuova reazione sviluppata dal team dell'UoC supera tali limiti e prende di mira i legami primari rispetto a quelli secondari. Lo fa utilizzando 2-metilfenantrolina con iridio, un approccio che è stato trovato per accelerare i tempi di reazione di circa il 50-80%. Il tempo di reazione più rapido ha consentito al team di utilizzare meno substrato. I ricercatori notano che la selettività nel prendere di mira il legame primario era particolarmente evidente con l'acido deidroabietico. Hanno anche notato che quando i legami C–H primari sono bloccati o assenti, sono presi di mira i legami C–H secondari.
Il fatto che la loro reazione sia una borilazione dovrebbe renderlo particolarmente utile ai chimici, i ricercatori credono, perché il boro è uno dei gruppi funzionali più versatili. Il loro nuovo approccio consentirà di assumere gruppi alchilici non reattivi attraverso un processo di sintesi in cui possono essere convertiti in legami carbonio-boro, che, notano, dovrebbe essere molto utile perché in seguito, il C–B può essere trasformato in un'ampia varietà di gruppi funzionali.
Un possibile problema con la reazione potrebbe essere la scelta del solvente giusto:dovrà essere uno che non subisca di per sé una reazione. I ricercatori hanno utilizzato cicloottano, ma riconoscere che è necessario sviluppare un solvente più polare per un uso più generale. Notano anche che la prossima volta hanno intenzione di capire perché la reazione prende di mira i legami più difficili.
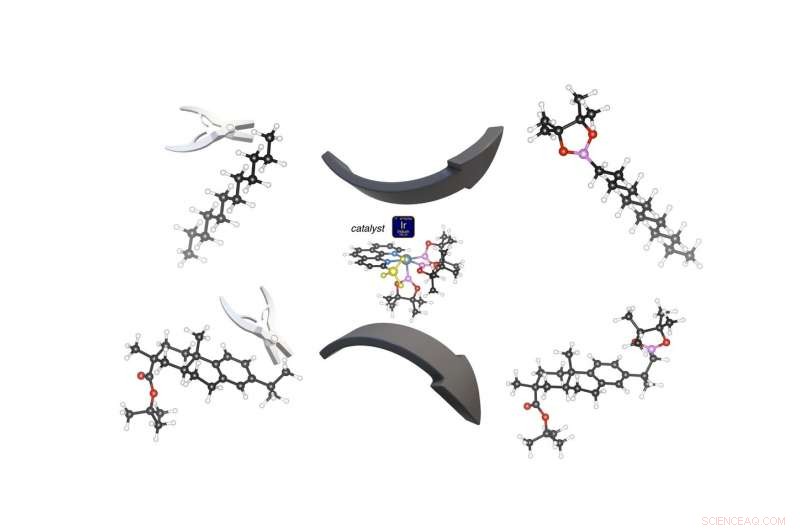
Un catalizzatore (al centro) a base di iridio (sfera blu) può tagliare un atomo di idrogeno (sfere bianche) da un gruppo metilico terminale (in alto e in basso a sinistra) per aggiungere un composto di boro-ossigeno (rosa e rosso) che può essere facilmente sostituito con gruppi chimici più complessi. La reazione funziona su semplici catene di idrocarburi (reazione superiore) o composti di carbonio più complicati (reazione inferiore). La squisita selettività di questa reazione catalitica è dovuta al gruppo metilico (giallo) che è stato aggiunto al catalizzatore di iridio. Le sfere nere sono atomi di carbonio; il rosso è ossigeno; il rosa è boro. (Immagine dell'UC Berkeley di John Hartwig) Credito:John Hartwig, UC Berkeley
© 2020 Scienza X Rete