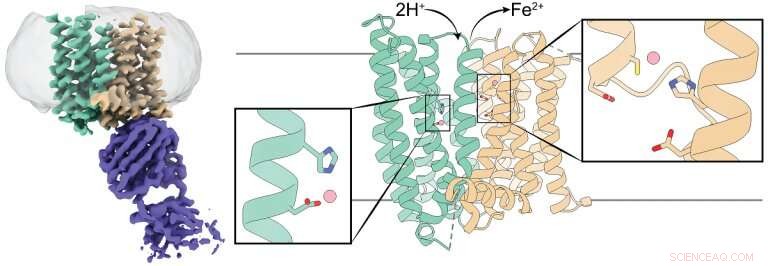
Struttura 3D di una ferroportina di mammifero. Il pannello di sinistra mostra una mappa di densità crio-EM di ferroportina (verde acqua e marrone) in complesso con un anticorpo (viola). I pannelli centrale e destro mostrano una rappresentazione a cartone animato di ferroportina con i suoi domini N e C colorati in verde acqua e marrone, rispettivamente. Ogni dominio ha un sito di legame degli ioni di ferro contrassegnato da un riquadro rettangolare, e i residui che coordinano gli ioni di ferro sono mostrati come bastoncini. Credito:Jiemin Shen/laboratorio Zhou/ Comunicazioni sulla natura , 2020.
Troppo o troppo poco ferro nel corpo può portare a malattie, ma gli organismi hanno sviluppato modi per mantenere i livelli di ferro in equilibrio. Ferroportin, l'unico esportatore di ferro conosciuto che rilascia ferro nel flusso sanguigno, è una componente cruciale dei meccanismi di bilanciamento del ferro.
Cercando di raggiungere una migliore comprensione della regolazione del ferro, un team guidato da ricercatori del Baylor College of Medicine ha analizzato la struttura 3-D di una ferroportina di mammifero, rivelando caratteristiche inaspettate e una nuova modalità di azione che può guidare lo sviluppo di strategie terapeutiche innovative. Lo studio appare in Comunicazioni sulla natura .
"Più di 60 mutazioni nel gene della ferroportina sono state associate a malattie umane. Alcune di queste mutazioni rendono la ferroportina insensibile all'epcidina, un ormone peptidico sintetizzato nel fegato che contribuisce alla regolazione della ferroportina, " ha detto l'autore corrispondente Dr. Ming Zhou, Ruth McLean Bowman Bowers Professore di biochimica e biologia molecolare. Zhou è anche membro del Dan L Duncan Comprehensive Cancer Center di Baylor.
Ferroportina ed epcidina coordinano le loro attività per mantenere il ferro nell'organismo nel giusto equilibrio. Ferroportin esporta ferro nel sangue, e l'epcidina controlla che le esportazioni non superino il fabbisogno. Quando non risponde all'epcidina, la ferroportina rimane attiva. Di conseguenza, il corpo è gravato di ferro, una condizione chiamata malattia da sovraccarico di ferro.
"Vorremmo comprendere meglio il processo di regolamentazione del trasporto del ferro osservando la struttura del ferroportino, " ha detto il co-primo autore Dr. Yaping Pan, assistente professore di biochimica e biologia molecolare al Baylor. "Non sono state descritte né la struttura della ferroportina né la struttura della ferroportina e dell'epcidina insieme. Uno sguardo più attento a queste strutture fornirebbe nuove informazioni su come funziona la ferroportina e su come l'epcidina regola la sua attività, aprendo possibilità a nuovi approcci per il trattamento della malattia da sovraccarico di ferro".
Una proteina impegnativa
I ricercatori hanno studiato la ferroportina del primate tarsier filippino, che è più del 90% simile alla ferroportina umana. Precedenti studi che hanno esaminato la ferroportina batterica e altri trasportatori di ferro avevano dimostrato che queste proteine hanno un solo sito di legame del ferro, portano un gruppo di ferro alla volta.
"Abbiamo iniziato il nostro studio supponendo che la ferroportina tarsiera avesse anche un sito di legame del ferro e siamo rimasti piuttosto perplessi dai risultati dei nostri esperimenti, " ha detto il co-primo autore Jiemin Shen, studente laureato in bioscienze quantitative e computazionali nel laboratorio Zhou.
Ad esempio, il team ha condotto esperimenti per determinare in che modo l'alterazione del sito di legame del ferro avrebbe influenzato la struttura 3-D della ferroportina. Sono rimasti incuriositi quando hanno scoperto che alterare il sito non sembrava avere un grande effetto, l'opposto di quello che si aspettavano. Una volta rivelata la struttura della ferroportina con la microscopia crioelettronica, ci siamo resi conto che ha due siti di legatura del ferro. Questa è stata una sorpresa che ha spiegato i dati che ci avevano sconcertato".
"Stavamo modificando solo un sito e sembra che l'altro sito fosse ancora al lavoro per legare il ferro, quindi non abbiamo visto molti cambiamenti nella struttura del ferroportin, "Ha detto Shen.
Una seconda scoperta davvero entusiasmante è stata che la modalità d'azione del ferroportino tarsier è diversa da quelle riportate per altri trasportatori di ferro, " Disse Zhu.
"Le esportazioni di ferroportina di ioni di ferro trasportano due cariche elettriche positive. Abbiamo scoperto che quando la ferroportina esporta ioni di ferro, protoni, che hanno una carica positiva, vengono trasportati nella cellula, bilanciare le spese e facilitare l'ulteriore esportazione di ferro, " disse Pan.
"Stiamo usando questi nuovi risultati strutturali e funzionali per identificare piccole molecole candidate in grado di regolare la ferroportina. Stiamo anche studiando la ferroportina umana, " Zhou ha detto. "Questo progetto ha un buon potenziale per tradurre i risultati al capezzale".