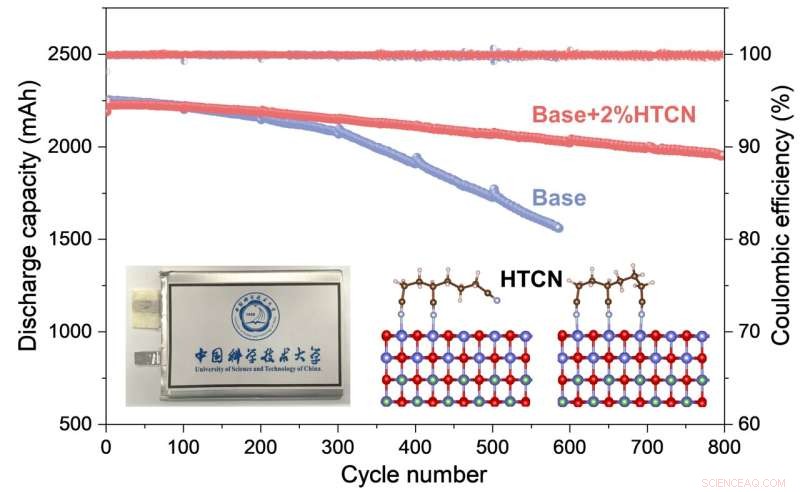
Le prestazioni elettrochimiche e il meccanismo di lavoro dell'additivo HTCN su LiCoO2 ad alta tensione catodo per pratiche celle a sacchetto sono studiati in modo completo. Credito:Nano ricerca
I nitrili, un composto organico con un atomo di carbonio triplo legato a un atomo di azoto, vengono comunemente aggiunti alla formula dell'elettrolita per le batterie che utilizzano un catodo di ossido di cobalto di litio, rendendo tali batterie molto più vicine alla realizzazione delle loro prestazioni teoriche complete. Fino ad ora, i ricercatori sulle batterie non hanno davvero capito perché questi nitrili funzionino in questo modo. Ma un gruppo di elettrochimici ha utilizzato tecniche di microscopia avanzate per dare un'occhiata più da vicino a ciò che accade su scala molecolare e ha identificato cosa sta succedendo, aprendo nuove strade per ulteriori miglioramenti delle prestazioni della batteria.
Lo studio è stato pubblicato sulla rivista Nano Research il 22 settembre 2022..
Ossido di cobalto di litio (LiCoO2 , o semplicemente "LCO") è il materiale più utilizzato per i catodi, gli elettrodi positivi, nelle batterie agli ioni di litio. Ciò è particolarmente vero per le batterie utilizzate nei dispositivi elettronici portatili grazie all'elevata tensione operativa dell'LCO, alla sua elevata capacità e alla stabilità delle sue prestazioni a lungo termine.
Ma ciò che ha reso i catodi LCO particolarmente attraenti è che offrono più energia per una minore quantità di spazio (maggiore densità di energia), che è molto utile per dispositivi di consumo più piccoli come telefoni, smartwatch e gadget che hanno vincoli di spazio ancora più rigorosi come come sensori intelligenti domestici e industriali.
Tuttavia, al momento, i catodi LCO possono fornire solo circa la metà della loro capacità specifica teorica. Ciò significa che ciò che effettivamente forniscono è molto inferiore a quello che dovrebbero essere teoricamente in grado di produrre. E quindi spesso trovano difficile soddisfare le crescenti richieste di densità di energia dell'elettronica portatile.
Un modo per aggirare questo ostacolo sarebbe aumentare la tensione di carica limitata delle batterie utilizzando catodi LCO. La tensione di carica limitata descrive il punto in cui una batteria è considerata completamente carica. Oltre questo punto, la batteria potrebbe essere danneggiata e così tanti dispositivi si spengono quando viene raggiunta la soglia di interruzione. Questa soglia è impostata in modo alquanto arbitrario, quindi potrebbe essere aumentata, e tale funzionamento ad alta tensione promette di dare un aumento della densità di energia a tali batterie.
Ma qui sorge un nuovo problema:il funzionamento ad alta tensione può esacerbare reazioni chimiche dannose all'interfaccia tra il catodo e l'elettrolita. Ciò può causare crepe e altri danni interni, che a loro volta possono deteriorare ulteriormente l'interfaccia tra gli elettrodi. In definitiva, tutto ciò può comportare un calo radicale della capacità della batteria e un forte aumento dei problemi di sicurezza. La temperatura di lavoro in questi dispositivi può raggiungere i 45 ℃ a causa della loro stessa generazione di calore, riducendo ulteriormente la durata della batteria.
E così da qualche tempo, mescolando composti aggiuntivi alla formula dell'elettrolita per modificare l'attività di reazione dell'elettrolita (il mezzo contenente ioni che aiuta a stabilire una corrente attraverso il movimento di ioni positivi e negativi attraverso di esso) all'interfaccia tra il catodo e l'elettrolito ha dimostrato di essere una strategia molto efficace per diminuire l'attività di reazione dell'elettrolita.
Esistono numerosi composti diversi utilizzati come tali additivi elettrolitici, ma per le batterie agli ioni di litio, i nitrili sono forse i più utilizzati. I nitrili sono qualsiasi composto organico che ha una sezione della molecola (un gruppo funzionale) costituita da un atomo di carbonio triplo legato a un atomo di azoto.
Tuttavia, il meccanismo di funzionamento degli additivi nitrilici sui catodi ad alta tensione non è ancora completamente compreso, in particolare nel tipo di pratiche batterie a sacca LCO ad alta tensione di uso quotidiano. (Le batterie a sacca sono un tipo di batteria "morbida" senza un involucro di metallo duro, e invece i cui componenti sono racchiusi in una pellicola di plastica rivestita di alluminio, che assomiglia un po' a una "sacca" di gomma da masticare o tabacco sfuso. Sviluppata per la prima volta nel 1995 e consentendo un uso molto più efficiente dello spazio, le batterie a sacchetto sono diventate da allora una scelta comune per i produttori grazie a questo vantaggio di progettazione.)
Esistono due teorie principali che cercano di spiegare il meccanismo degli additivi nitrilici, ma entrambe presentano notevoli carenze nel loro potere esplicativo.
"I nitrili funzionano bene, ma non sappiamo davvero perché funzionino bene, perché si stia verificando questa azione stabilizzante. Esattamente quello che sta succedendo è rimasto piuttosto misterioso", ha affermato Shuhong Jiao, elettrochimico presso l'Università di Scienza e Tecnologia della Cina (USTC). "E se non sappiamo perché ciò che stiamo facendo per migliorare le batterie sta funzionando, questo ci impedisce di mettere a punto i nostri sforzi per migliorare ulteriormente le cose."
Quindi i ricercatori hanno preso un comune additivo elettrolitico nitrilico, 1,3,6-esanetricarbonitrile contenente ligando tridentato (o più semplicemente HTCN) per cercare di fare luce su quale sia il meccanismo dei nitrili nella stabilizzazione ad alta tensione di un LiCoO2 catodo.
Mentre la batteria era in funzione e superava di gran lunga un equivalente senza gli additivi elettrolitici HTCN, i ricercatori hanno utilizzato la microscopia elettronica per dare un'occhiata più da vicino a ciò che stava accadendo, combinata con un'analisi della composizione ionica e elementare del sistema. Hanno scoperto che l'additivo HTCN inibiva in modo molto efficace la generazione di crepe e la dissoluzione degli ioni di cobalto.
Quindi, utilizzando la spettroscopia fotoelettronica a raggi X combinata con una serie di calcoli teorici, hanno scoperto che le molecole HTCN venivano adsorbite in modo efficiente sulla superficie dell'LCO e incorporate nell'interfaccia tra il catodo e l'elettrolita, che in girare inibiscono notevolmente una reazione di ossidazione sulla superficie dell'LCO, impedendo così una continua decomposizione dell'elettrolita.
Complessivamente, ciò equivale a un'interfaccia molto più stabile tra catodo ed elettrolita, che ha soppresso in modo significativo la decomposizione dei componenti e la formazione di crepe. È questa struttura catodica-elettrolita stabile e densa che migliora la stabilità della batteria attraverso moltissimi cicli di carica e scarica.
Conoscendo questa comprensione a livello molecolare di come gli additivi nitrilici danno una spinta a tali batterie, i ricercatori possono ora cercare altre formulazioni di additivi elettrolitici che producono una struttura dell'interfaccia simile o migliore. + Esplora ulteriormente