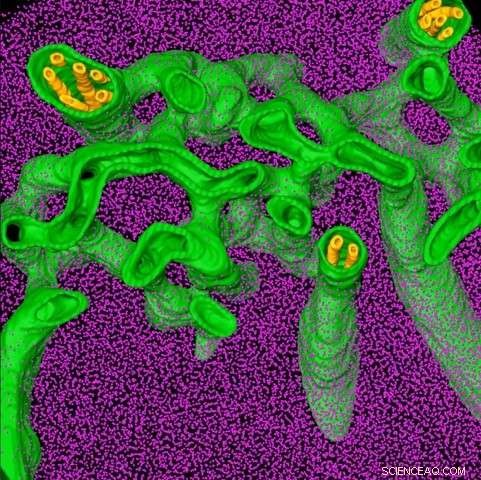
Due nuovi studi condotti da Princeton forniscono uno sguardo dettagliato su una parte essenziale del meccanismo di crescita delle alghe, con l'obiettivo finale di applicare queste conoscenze al miglioramento della crescita delle colture. In questa immagine, i ricercatori hanno utilizzato una tecnica chiamata tomografia crioelettronica per visualizzare una struttura algale chiamata pirenoide, che concentra l'anidride carbonica per renderla più prontamente disponibile per gli enzimi fotosintetici (viola). Si pensa che i tubuli gialli all'interno dei tubi verdi portino carbonio e altri materiali nel pirenoide. Credito:Benjamin Engel, Istituto Max Planck di biochimica
Due nuovi studi sulle alghe verdi, il flagello dei proprietari di piscine e stagni d'acqua dolce, hanno rivelato nuove intuizioni su come questi organismi assorbono l'anidride carbonica dall'aria per utilizzarla nella fotosintesi, un fattore chiave nella loro capacità di crescere così rapidamente. Comprendere questo processo potrebbe un giorno aiutare i ricercatori a migliorare il tasso di crescita di colture come grano e riso.
Negli studi pubblicati questa settimana sulla rivista Cellula , il team guidato da Princeton ha riportato il primo inventario dettagliato del macchinario cellulare, situato in un organello noto come pirenoide, utilizzato dalle alghe per raccogliere e concentrare l'anidride carbonica. I ricercatori hanno anche scoperto che il pirenoide, a lungo ritenuto una struttura solida, in realtà si comporta come una gocciolina liquida che può dissolversi nel mezzo cellulare circostante quando le cellule algali si dividono.
"Capire come le alghe possono concentrare l'anidride carbonica è un passo fondamentale verso l'obiettivo di migliorare la fotosintesi in altre piante, " ha detto Martin Jonikas, un assistente professore di biologia molecolare a Princeton e leader degli studi, che includeva collaboratori presso il Max Planck Institute of Biochemistry in Germania e il Carnegie Institution for Science nel campus della Stanford University. "Se potessimo progettare altre colture per concentrare il carbonio, potremmo affrontare la crescente domanda mondiale di cibo, " ha detto Jonika.
Le alghe acquatiche e una manciata di altre piante hanno sviluppato meccanismi di concentrazione del carbonio che aumentano il tasso di fotosintesi, il processo mediante il quale le piante trasformano l'anidride carbonica e la luce solare in zuccheri per la crescita. Tutte le piante utilizzano un enzima chiamato Rubisco per "fissare" l'anidride carbonica nello zucchero che può essere utilizzato o immagazzinato dalla pianta.
Le alghe hanno un vantaggio su molte piante terrestri perché raggruppano gli enzimi di Rubisco all'interno del pirenoide, dove gli enzimi incontrano alte concentrazioni di anidride carbonica pompata dall'aria. Avere più anidride carbonica in giro permette agli enzimi Rubisco di lavorare più velocemente.
Nel primo dei due studi riportati questa settimana, i ricercatori hanno condotto un'ampia ricerca di proteine coinvolte nel meccanismo di concentrazione del carbonio di una specie di alghe nota come Chlamydomonas reinhardtii. Utilizzando tecniche sviluppate dai ricercatori per etichettare e valutare rapidamente le proteine algali, i ricercatori hanno identificato le posizioni e le funzioni di ciascuna proteina, dettagliare le interazioni fisiche tra le proteine per creare un "interattoma" pirenoide.
La ricerca ha rivelato 89 nuove proteine pirenoidi, compresi quelli che i ricercatori pensano introducano carbonio nel pirenoide e altri che sono necessari per la formazione del pirenoide. Hanno anche identificato tre strati precedentemente sconosciuti del pirenoide che circondano l'organello come gli strati di una cipolla. "Le informazioni rappresentano la migliore valutazione finora di come è organizzato questo essenziale macchinario per la concentrazione del carbonio e suggeriscono nuove strade per esplorare come funziona, "ha detto Luke Mackinder, il primo autore dello studio ed ex ricercatore post-dottorato presso la Carnegie Institution che ora guida un team di ricercatori presso l'Università di York, UK.
Nel secondo studio, i ricercatori riferiscono che il pirenoide, a lungo ritenuto una struttura solida, è in realtà simile a un liquido. Le tecniche utilizzate negli studi precedenti richiedevano ai ricercatori di uccidere e preservare chimicamente le alghe prima di visualizzarle. In questo nuovo studio, i ricercatori hanno ripreso le alghe mentre gli organismi vivevano utilizzando una proteina fluorescente gialla per etichettare Rubisco.
Osservando le alghe, Elizabeth Freeman Rosenzweig, poi uno studente laureato della Carnegie Institution, e Mackinder ha usato un laser ad alta potenza per distruggere l'etichetta fluorescente su Rubisco in metà del pirenoide, lasciando intatta l'etichetta nell'altra metà del pirenoide. Entro pochi minuti, la fluorescenza ridistribuita all'intero pirenoide, dimostrando che gli enzimi si spostano facilmente come farebbero in un liquido.
Beniamino Engel, ricercatore post-dottorato e capo progetto presso il Max Planck Institute of Biochemistry, ha ulteriormente esplorato questa scoperta utilizzando un'altra tecnica di imaging chiamata tomografia crioelettronica. Ha congelato e preparato intere cellule di alghe e poi le ha riprese con un microscopio elettronico, che è così sensibile da poter risolvere le strutture delle singole molecole.
La tecnica ha consentito a Engel di visualizzare il pirenoide in tre dimensioni ea risoluzione nanometrica. Confrontando queste immagini con quelle dei sistemi liquidi, i ricercatori hanno confermato che il pirenoide era organizzato come un liquido. "Questo è uno dei rari esempi in cui la genetica classica, la biologia cellulare e gli approcci di imaging ad alta risoluzione sono stati riuniti in un'unica indagine, " disse Engel.
Lo studio ha permesso al team di chiedersi come un pirenoide viene trasmesso alla generazione successiva quando le alghe unicellulari si dividono in due cellule figlie. Freeman Rosenzweig ha notato che il pirenoide a volte non riesce a dividersi, lasciando una delle cellule figlie senza pirenoide.
Utilizzando le proteine fluorescenti, il team ha osservato che la cellula che non è riuscita a ricevere metà del pirenoide in effetti potrebbe ancora formarne uno spontaneamente. Hanno scoperto che ogni cellula figlia riceve una certa quantità del pirenoide nella sua forma disciolta e che questi componenti quasi non rilevabili possono condensarsi in un pirenoide a tutti gli effetti.
"Pensiamo che la dissoluzione dei pirenoidi prima della divisione cellulare e la condensazione dopo la divisione possano essere un meccanismo ridondante per garantire che entrambe le cellule figlie ricevano i pirenoidi, " disse Jonikas. "In questo modo, entrambe le cellule figlie avranno questo organello chiave che è fondamentale per assimilare il carbonio".
Per esplorare ulteriormente come ciò potrebbe accadere, Jonikas ha collaborato con Ned Wingreen, Howard A. Prior Professor di Princeton in Scienze della Vita e Biologia Molecolare. Wingreen e il suo team hanno creato una simulazione al computer delle interazioni tra Rubisco e un'altra proteina chiamata EPYC1, scoperta cruciale per il pirenoide da Mackinder e da altri membri del team di Jonikas, che agisce come colla per incollare più Rubisco.
La simulazione al computer ha suggerito che lo stato del pirenoide, se una gocciolina di liquido condensato o disciolto nel compartimento circostante, dipendeva dal numero di siti di legame su EPYC1. Nella simulazione, Rubisco ha otto siti di legame, o otto posti in cui EPYC1 può attraccare a un Rubisco. Se EPYC1 ha quattro siti di legame, quindi due EPYC1 riempiono esattamente tutti i siti di attracco su un Rubisco, e viceversa. Poiché questi complessi Rubisco-EPYC1 completamente legati sono piccoli, formano uno stato disciolto. Ma se EPYC1 ha tre o cinque siti di legame, non può riempire tutti i siti di Rubisco, e ci sono siti aperti sui Rubiscos per il legame con EPYC1 aggiuntivi, che hanno anche siti gratuiti che possono attirare altri Rubiscos. Il risultato è un gruppo di Rubisco ed EPYC1 che formano una gocciolina simile a un liquido.
Il cambiamento di fase del sistema in funzione del rapporto tra EPYC1 e siti di legame di Rubisco può essere considerato un effetto "numero magico", un termine tipicamente usato in fisica per descrivere condizioni in cui un numero specifico di particelle forma uno stato insolitamente stabile. "Questi numeri magici, oltre ad essere rilevante per i sistemi pirenoidi, potrebbe avere una certa importanza nel campo della fisica dei polimeri e potenzialmente nella biologia sintetica, "Ha detto Wingreen.
Wingreen e Jonikas stanno continuando la loro collaborazione e sperano di sviluppare il progetto sia teoricamente, esplorando diverse flessibilità e configurazioni di Rubisco ed EPYC1, sia sperimentalmente, combinando le due proteine in una provetta e manipolando il numero di siti di legame.
"Il pensiero precedente era che più siti vincolanti hanno, più le proteine tendono a raggrupparsi, " ha detto Jonikas. "La scoperta che esiste un effetto numero magico è importante non solo per i pirenoidi, ma forse per molti altri organelli liquidi che si trovano in natura".
Con ulteriori studi, questi risultati possono fornire importanti spunti per garantire la disponibilità di colture a crescita rapida per una popolazione mondiale in espansione.