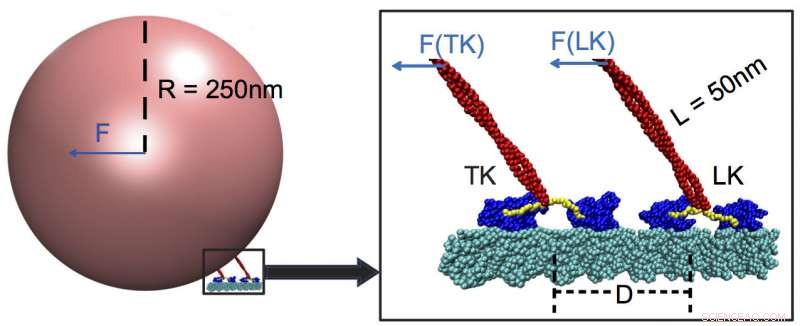
Due kinesine portanti mentre trasportano il carico lungo un microtubulo (ciano). I ricercatori della Rice University e dell'Università di Houston hanno determinato che le proteine motorie rispondono meglio alle forze forti e quasi per niente a quelle deboli, anche quelli applicati da motori attaccati allo stesso carico. In questo esempio, la kinesina principale (LK) sostiene la maggior parte del carico, con teste motore (blu) azionate da un collarino (giallo) che si collega allo stelo (rosso) e rileva la presenza del carico. Credito:Centro di Fisica Biologica Teorica/Rice University
Se sei la proteina motore in primo piano, preparatevi a tirare pesantemente.
Questa è una conclusione di uno studio condotto dalla Rice University sui meccanismi che guidano le chinesine, proteine motorie che trasportano carichi all'interno delle cellule. Lo studio mostra che ci vuole molta forza contraria per rallentare una determinata chinesina. Né la proteina ottiene molto aiuto dai colleghi che fanno le retrovie.
Lo studio teorico dettagliato nel Atti dell'Accademia Nazionale delle Scienze e guidato dal ricercatore post-dottorato di Rice Qian Wang è stato uno sforzo collaborativo dei laboratori di tre professori alla Rice e uno all'Università di Houston, tutti lavorano sotto l'egida del Centro di Fisica Biologica Teorica (CTBP) di Rice.
Sperano di aumentare le conoscenze sui cavalli da lavoro poco compresi all'interno delle cellule che sono fondamentali per la divisione cellulare e per il trasporto di merci. Le chinesine difettose o carenti sono implicate nella malattia di Charcot-Marie-Tooth e in alcune malattie renali.
Attraverso simulazioni al computer, i ricercatori forniscono i primi dettagli a livello molecolare su come le chinesine rispondono alle forze esterne, confermando i precedenti esperimenti del coautore Michael Diehl che hanno mostrato che le squadre di chinesine funzionano meglio solo quando sono nelle immediate vicinanze e possono tirare nella stessa direzione.
"Capiamo più o meno i singoli motori, ", ha affermato il biofisico e coautore di Rice Anatoly Kolomeisky, la cui precedente ricerca ha mostrato che le proteine motorie sono sensibili alla presenza di altre. "In natura, lavorano in team, ma poiché i motori rispondono in modo relativamente debole a una gamma significativa di forze, sosteniamo che questa sia la ragione principale per cui le chinesine non sempre cooperano tra loro."
Le chinesine trasformano l'energia dall'ATP chimico, o adenosina trifosfato, in azione meccanica. Si attaccano a grandi carichi come i mitocondri oi cromosomi e li trascinano lungo i filamenti del citoscheletro fino alle estremità di una cellula. Ogni chinesina contiene due subunità "testa", e ogni subunità contiene due siti di legame:uno per afferrare e camminare lungo i microtubuli e l'altro per legare l'ATP.
I modelli hanno mostrato kinesine, una famiglia di molecole motorie scoperte nel 1985, sono "debolmente suscettibili" alle piccole o medie forze esterne e trascinano il loro carico attraverso un'opposizione quasi fortissima. Tra le forze deboli ci sono quelle applicate dalle kinesine trascinate attaccate allo stesso carico.
Si scopre che questi compagni di squadra si registrano a malapena al kinesin del capo se sono a più di 48 nanometri di distanza. Quando è così, la chinesina di piombo trasporta più del 90 percento del carico.
Le simulazioni di Rice hanno rivelato che il leader presta maggiore attenzione alla trazione del carico stesso, che attiva un "interruttore" nel linker del collo, parte dello stelo che tira il carico come una corda su un pallone. Il linker accoppia il carico ai siti di legame dell'ATP dei motori di testa, che a sua volta controlla la velocità. Una kinesina finale troppo lontana non percepisce la forza e quindi non può contribuire con i suoi muscoli.
"Quando il motore è in movimento, il linker del collo viene teso, ", ha detto il biofisico di Rice José Onuchic, co-autore e co-direttore del CTBP. "Se quel linker non è teso, il motore perde velocità perché non può prendere una decisione da solo. Questa competizione tra deformazione e legame al microtubulo è necessaria per garantire la processività di questo motore".
La simulazione di base consentirà ai ricercatori di testare più chinesine che spostano il carico dal nucleo ai limiti esterni della cellula e, infine, dineina, proteine più grandi e complesse che spostano il carico verso il centro.
"Devi fare questo primo passo molto bene e in molti dettagli per prendere confidenza prima di affrontare una bestia come il dynein, " Diehl ha detto. "Questi ragazzi hanno lavorato molto duramente per anni attraverso molteplici studi e hanno unito le forze, collettivamente, un modo per enumerare e analizzare le transizioni tra i passaggi chiave di questo processo meccanico.
"Ora, essere in grado di adottare quell'approccio a un motore come il dynein ha l'opportunità di spiegare molte cose importanti, misteri fondamentali su come funziona una proteina così complessa, " Egli ha detto.
"È il tipo di studio che un singolo investigatore principale troverebbe difficile da fare, " Disse Onuchic. "Per problemi così complicati, è bello avere questa combinazione di talento".