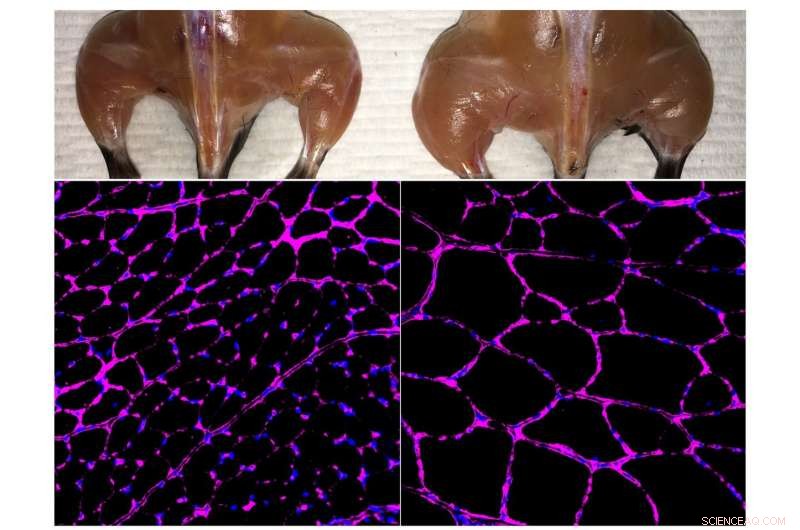
L'avanzato sistema di attivazione del gene epigenetico in vivo basato su Cas9 del laboratorio Belmonte migliora la massa muscolare scheletrica (in alto) e la crescita delle dimensioni delle fibre (in basso) in un topo trattato (a destra) rispetto a un controllo indipendente (a sinistra). Le immagini al microscopio a fluorescenza in basso mostrano la colorazione viola della glicoproteina della laminina nelle fibre del muscolo tibiale anteriore. Credito:Salk Institute
Gli scienziati di Salk hanno creato una nuova versione della tecnologia di modifica del genoma CRISPR/Cas9 che consente loro di attivare i geni senza creare rotture nel DNA, potenzialmente aggirando un grosso ostacolo all'utilizzo di tecnologie di editing genetico per curare le malattie umane.
La maggior parte dei sistemi CRISPR/Cas9 funziona creando "rotture a doppio filamento" (DSB) in regioni del genoma mirate per l'editing o per la delezione, ma molti ricercatori si oppongono alla creazione di tali rotture nel DNA degli esseri umani viventi. Come prova del concetto, il gruppo Salk ha usato il suo nuovo approccio per curare diverse malattie, compreso il diabete, malattia renale acuta, e distrofia muscolare, nei modelli di topo.
"Sebbene molti studi abbiano dimostrato che CRISPR/Cas9 può essere applicato come un potente strumento per la terapia genica, ci sono crescenti preoccupazioni riguardo alle mutazioni indesiderate generate dalle rotture del doppio filamento attraverso questa tecnologia, "dice Juan Carlos Izpisua Belmonte, un professore nel laboratorio di espressione genica di Salk e autore senior del nuovo articolo, pubblicato in Cellula il 7 dicembre 2017. "Siamo stati in grado di aggirare questa preoccupazione."
Nel sistema CRISPR/Cas9 originale, l'enzima Cas9 è accoppiato con RNA guida che lo indirizzano al punto giusto nel genoma per creare DSB. Recentemente, alcuni ricercatori hanno iniziato a utilizzare una forma "morta" di Cas9 (dCas9), che può ancora colpire luoghi specifici nel genoma, ma non taglia più il DNA. Anziché, dCas9 è stato accoppiato con domini di attivazione trascrizionale, interruttori molecolari, che attivano geni mirati. Ma la proteina risultante, dCas9 attaccata agli interruttori dell'attivatore, è troppo grande e ingombrante per entrare nel veicolo normalmente utilizzato per fornire questo tipo di terapie alle cellule degli organismi viventi, vale a dire virus adeno-associati (AAV). La mancanza di un sistema di somministrazione efficiente rende molto difficile l'utilizzo di questo strumento nelle applicazioni cliniche.
Il team di Izpisua Belmonte ha combinato Cas9/dCas9 con una gamma di diversi attivatori per scoprire una combinazione che funzionava anche quando le proteine non erano fuse tra loro. In altre parole, Cas9 o dCas9 è stato impacchettato in un AAV, e gli interruttori e gli RNA guida sono stati impacchettati in un altro. Hanno anche ottimizzato gli RNA guida per assicurarsi che tutti i pezzi finissero nel punto desiderato nel genoma, e che il gene bersaglio era fortemente attivato.
"I componenti lavorano tutti insieme nell'organismo per influenzare i geni endogeni, " dice Hsin-Kai (Ken) Liao, un ricercatore del personale nel laboratorio di Izpisua Belmonte e co-primo autore del nuovo articolo. In questo modo, la tecnologia opera epigeneticamente, il che significa che influenza l'attività del gene senza modificare la sequenza del DNA.
Per testare il metodo, i ricercatori hanno utilizzato modelli murini di danno renale acuto, diabete di tipo 1 e una forma di distrofia muscolare. In ogni caso, hanno progettato il loro sistema CRISPR/Cas9 per aumentare l'espressione di un gene endogeno che potrebbe potenzialmente invertire i sintomi della malattia. In caso di malattia renale, hanno attivato due geni noti per essere coinvolti nella funzione renale, e osservato non solo un aumento dei livelli delle proteine associate a quei geni, ma una migliore funzionalità renale a seguito di una lesione acuta. Per il diabete di tipo 1, miravano a potenziare l'attività dei geni che potrebbero generare cellule produttrici di insulina. Di nuovo, il trattamento ha funzionato, abbassare i livelli di glucosio nel sangue in un modello murino di diabete. Per la distrofia muscolare, i ricercatori hanno espresso geni che in precedenza avevano dimostrato di invertire i sintomi della malattia, compreso un gene particolarmente grande che non può essere facilmente consegnato tramite le tradizionali terapie geniche mediate da virus.
"Eravamo molto emozionati quando abbiamo visto i risultati sui topi, " aggiunge Fumiyuki Hatanaka, un ricercatore associato in laboratorio e co-autore del documento. "Possiamo indurre l'attivazione del gene e allo stesso tempo vedere cambiamenti fisiologici".
Il team di Izpisua Belmonte sta ora lavorando per migliorare la specificità del proprio sistema e applicarlo a più tipi di cellule e organi per trattare una gamma più ampia di malattie umane, nonché per ringiovanire organi specifici e per invertire il processo di invecchiamento e le condizioni legate all'età come la perdita dell'udito e la degenerazione maculare. Saranno necessari ulteriori test di sicurezza prima delle sperimentazioni umane, dicono.