Rappresentazione artistica di un'unità organizzativa disassemblata del DNA, un dominio di associazione topologica (TAD). Nell'analisi dei dati, questi domini appaiono come triangoli che possono essere ristrutturati in diversi tessuti. Credito:Alessa Ringel/MPIMG
Gli strati di controllo genico consentono al DNA di aggiungere in modo flessibile nuove informazioni. I geni e i loro interruttori genetici sono organizzati in unità funzionali per attivare o disattivare i geni secondo necessità. L'interruzione di queste unità può portare alla malattia, ma un nuovo studio chiarisce che sono più robuste e flessibili di quanto si pensasse in precedenza. Un team internazionale di ricercatori ha scoperto che un gene può ancora funzionare anche quando nuovi segmenti di DNA vengono inseriti nella stessa unità organizzativa genomica.
Due metri di DNA sono inseriti nel minuscolo nucleo di ogni cellula umana. Per fornire alla cellula le informazioni giuste al momento giusto, la molecola di DNA viene impacchettata e raggruppata in modo efficiente in unità funzionali. I geni di solito si riuniscono con le loro sequenze di controllo per costruire spazi di lavoro fisicamente separati. Ma cosa succede quando queste unità vengono disturbate durante l'evoluzione o nel genoma di un singolo paziente?
"Alcuni dei riarrangiamenti genomici che vediamo nella clinica causano malattie, mentre altri no", afferma Stefan Mundlos della Charité—Universitätsmedizin Berlin e capo del gruppo di ricerca Development &Disease presso il Max Planck Institute for Molecular Genetics (MPIMG). "Non capiamo ancora del tutto perché questo sia il caso."
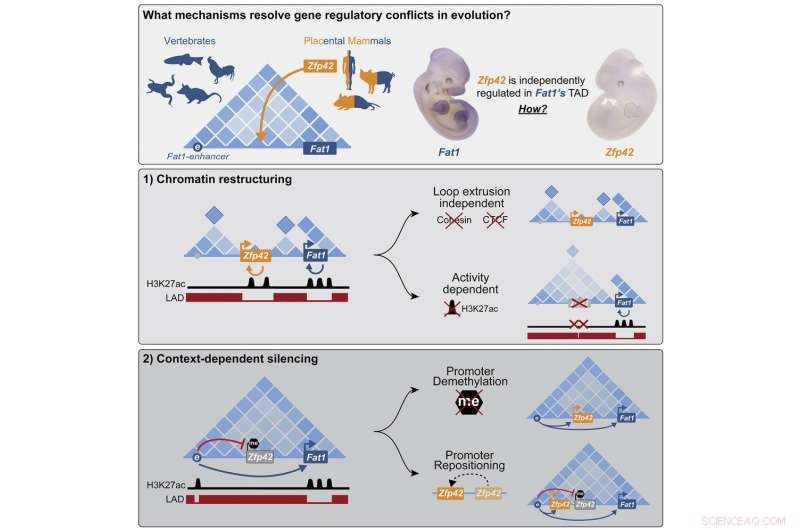
In effetti, molte parti del genoma contengono conflitti regolatori. Un nuovo studio pubblicato sulla rivista Cell dà i primi suggerimenti su come si risolvono. Il team di ricercatori di Mundlos ha studiato un esempio in cui un nuovo gene è stato integrato con successo nel genoma senza disturbare i meccanismi di controllo preesistenti dei geni vicini. Il team sperava che questo potesse essere utilizzato anche per trarre conclusioni su circostanze simili nelle cellule dei pazienti.
I ricercatori hanno esplorato una mutazione avvenuta nell'antenato di tutti i mammiferi placentari, un gruppo che include gli esseri umani, ma non i marsupiali come l'opossum. La mutazione ha inserito il nuovo gene Zfp42 proprio nello spazio di lavoro dell'importante gene evolutivo Fat1, un gene coinvolto nella crescita e nella migrazione delle cellule.
"Abbiamo scoperto che le cellule affrontano l'ospite indesiderato con due meccanismi separati, a seconda della situazione in cui i geni sono necessari", afferma Michael Robson, che ha guidato il progetto. "In alcuni tessuti, il nuovo gene viene silenziato epigeneticamente e completamente disattivato. Durante lo sviluppo iniziale dell'embrione, tuttavia, entrambi i geni sono attivi e la cellula ricostruisce questa parte del genoma in nuove unità funzionali che consentono il controllo individuale".
Un nuovo arrivato in officina
Robson, il suo dottorato di ricerca la studentessa Alessa Ringel e i loro colleghi hanno studiato lo spazio di lavoro organizzativo di Fat1. Come molti altri geni, viene istruito ad attivarsi in tempi e luoghi specifici da altre sequenze di DNA chiamate potenziatori. Per consentire a potenziatori e geni di comunicare, il DNA si piega e si piega per riunirli in uno spazio di lavoro protetto. Queste unità di lavoro funzionali del DNA sono chiamate domini associati topologicamente (TAD).
Nei polli o negli opossum, solo il gene Fat1 si trova nello stesso TAD dei suoi potenziatori. Quando il ricercatore ha utilizzato la tecnica "Hi-C" per vedere quali parti del DNA si toccano più frequentemente, il gene e il suo potenziatore si sono comportati come previsto. In questi animali, il DNA sembrava raggomitolarsi in un'unica palla, consentendo a entrambe le sequenze genetiche di mescolarsi, attivando così Fat1.
"Ma nei mammiferi placentari come i topi o gli esseri umani è un po' più complicato", spiega Ringel, che è il primo autore della pubblicazione. Proprio tra il gene Fat1 e il suo potenziatore, c'è questo nuovo gene chiamato Zfp42. Lo stesso potenziatore dovrebbe controllare entrambi i geni, ma non è così. "Entrambi i geni sembrano andare d'accordo:hanno un comportamento completamente indipendente, diventando attivi in diversi tessuti in diversi momenti dello sviluppo."
Astratto grafico. Credito:Cella (2022). DOI:10.1016/j.cell.2022.09.006
O vai a dormire o ricostruisci il tuo spazio di lavoro
Per andare a fondo della questione di come i geni riescano a evitarsi a vicenda, i ricercatori hanno confrontato cellule di diversi tessuti di topo:l'arto embrionale in via di sviluppo e le cellule staminali embrionali.
Da questi studi, i ricercatori hanno appreso che negli arti embrionali il potenziatore contatta effettivamente entrambi i geni, ma Zfp42 rimane inattivo. A quanto pare, il nuovo arrivato si trova ancora nello stesso spazio di lavoro ma dorme tranquillamente in un angolo. Il gene era stato messo a tacere dalla metilazione del DNA, una modifica chimica che blocca i geni in uno stato off. Ma per far addormentare il gene Zfp42, deve essere esattamente nel posto giusto. Non appena i ricercatori lo hanno tagliato e incollato sperimentalmente solo un po' su entrambi i lati, è stato attivato dal potenziatore di Fat1.
Gli scienziati sono rimasti sorpresi di scoprire che nelle cellule delle cellule staminali embrionali del topo, il DNA attorno ai due geni è organizzato in modo completamente diverso. Zfp42 e Fat1 ora creano i propri spazi di lavoro fisicamente separati con i rispettivi potenziatori.
Il TAD originale si divide in blob di DNA più piccoli per separare i due geni. Ciò era evidente non solo dagli esperimenti Hi-C che mappavano i punti di contatto tra i segmenti di DNA, ma anche dall'imaging microscopico ad alta risoluzione e dai modelli computerizzati che mostravano che ogni gene stabiliva il proprio piccolo spazio di lavoro.
Un sistema di controllo genetico robusto e flessibile
Questi due nuovi meccanismi rivelano come un singolo "spazio di lavoro" del DNA può essere facilmente modificato per ospitare attività geniche completamente diverse. "È affascinante studiare come diversi livelli di controllo genico si completino a vicenda", afferma Ringel. "Siamo rimasti sorpresi dalla flessibilità dei nostri genomi per adattarsi e controllare i geni in diverse situazioni. Ad esempio, i nostri risultati mostrano che i TAD possono avere strutture del DNA dinamiche anziché statiche".
Il TAD del gene Fat1 è stato mantenuto stabilmente per centinaia di milioni di anni di evoluzione da pesci e rane a marsupiali, aggiunge il leader del progetto Robson. "Gli spazi di lavoro TAD all'inizio sembrano fragili, perché molte cose possono andare storte se vengono disturbate", afferma. "Ma i nuovi geni devono andare da qualche parte e mostriamo come l'evoluzione può modificare efficacemente i domini regolatori per aggiungere in sicurezza nuovi geni e funzioni".
"È interessante notare che questa impostazione evolutiva rispecchia ciò che spesso vediamo nei pazienti con alterazioni genomiche estreme come la cromotripsi", afferma Mundlos. "Questi pazienti possono avere cromosomi in frantumi ma hanno ancora solo sintomi relativamente lievi. Ciò potrebbe essere spiegato attraverso questi meccanismi regolatori aggiuntivi che compensano gli effetti dannosi utilizzando gli strumenti che il genoma ha a sua disposizione". + Esplora ulteriormente