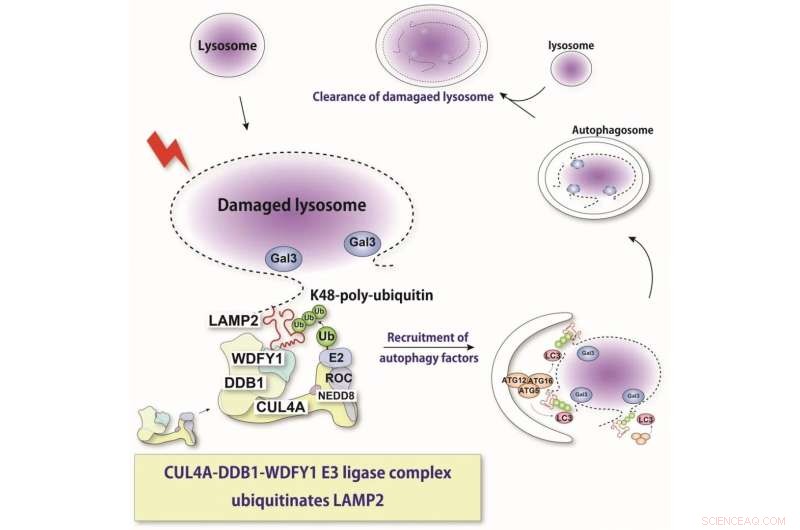
Il lisosoma è un organello intracellulare acido cruciale per la degradazione di vari componenti cellulari. In caso di danno alla membrana lisosomiale, le idrolasi lisosomiali vengono rilasciate nel citosol e inducono risposte allo stress o morte cellulare. Qui, mostriamo che un complesso proteico appena identificato riconosce i lisosomi danneggiati e ubiquitina un substrato, LAMP2. Questo riconoscimento induce l'autofagia selettiva. Credito:Keisuke Tabata
L'autofagia è un processo di autodegradazione che le cellule utilizzano per rimuovere i componenti non necessari o danneggiati. Esistono diverse forme di autofagia, inclusa la macroautofagia, che è un sistema di degradazione di massa utilizzato per indirizzare i materiali nel citosol della cellula agli organelli chiamati lisosomi per la rottura enzimatica. Tuttavia, anche i lisosomi stessi a volte devono essere degradati. Recentemente, i ricercatori dell'Università di Osaka hanno esaminato i dettagli molecolari specifici di come i lisosomi danneggiati vengono selezionati e contrassegnati per la clearance.
In un recente articolo pubblicato su Cell Reports , il team ha descritto un processo chiamato lisofagia, la forma specifica di autofagia selettiva responsabile dell'eliminazione dei lisosomi danneggiati. Studi precedenti hanno dimostrato che sostanze come tossine, lipidi e cristalli di colesterolo o urato possono rompere i lisosomi. Oltre a rendere disfunzionali gli organelli, questo danno può anche indurre stress ossidativo e infiammazione che possono portare allo sviluppo di malattie. Pertanto, la cellula utilizza la lisofagia per affrontare questo problema. Tuttavia, i meccanismi che controllano il modo in cui le cellule possono riconoscere i lisosomi danneggiati e indirizzarli alla degradazione non sono completamente compresi.
"Sappiamo da precedenti indagini che i lisosomi possono essere contrassegnati da un enzima specifico, SCFFBXO27 attraverso un processo chiamato poliubiquitinazione", afferma uno degli autori principali, Hirofumi Teranishi. "L'espressione di SCFFBXO27 è stata osservata solo nel cervello e nei tessuti muscolari, quindi abbiamo ipotizzato che un altro enzima più onnipresente debba esistere per la lisofagia in altri tipi di cellule".
Il team ha utilizzato perline di polistirene rivestite con un reagente che potrebbe indurre un danno endosomiale e quindi essere ubiquitinato. Hanno quindi isolato le perline mediante centrifugazione e hanno utilizzato un metodo chiamato spettrometria di massa per identificare le proteine ad esse associate, restringendo infine l'elenco a 123 proteine.
"Con l'aiuto di tecniche molecolari in cui potremmo abbattere l'espressione di queste varie proteine, abbiamo scoperto che le proteine chiamate CUL4A, DDB1 e WDFY1 compongono un complesso che risponde al danno lisosomiale", spiega Maho Hamasaki, autore senior dello studio.
Un'ulteriore caratterizzazione ha indicato che questo complesso agisce preferenzialmente durante la lisofagia e facilita l'aggiunta delle molecole di ubiquitina. La proteina WDFY1 è necessaria per riconoscere in modo specifico i lisosomi danneggiati.
"Ci siamo quindi chiesti quale parte del lisosoma è riconosciuta da questo complesso proteico", afferma Teranishi. "Sono state esaminate numerose proteine lisosomiali, finché non abbiamo scoperto che LAMP2 è quella ubiquitinata dal complesso CUL4A."
Il team ha anche scoperto che la presenza di LAMP2 e la sua interazione con WDFY1 sono essenziali per avviare il processo di lisofagia. Nel complesso, questi risultati forniscono spunti critici sui meccanismi molecolari che sono centrali per la lisofagia. Questo può anche aiutare a combattere le malattie in cui questo processo è disregolato. In futuro, i ricercatori intendono determinare dettagli più precisi su come il complesso CUL4A riconosce LAMP2. + Esplora ulteriormente