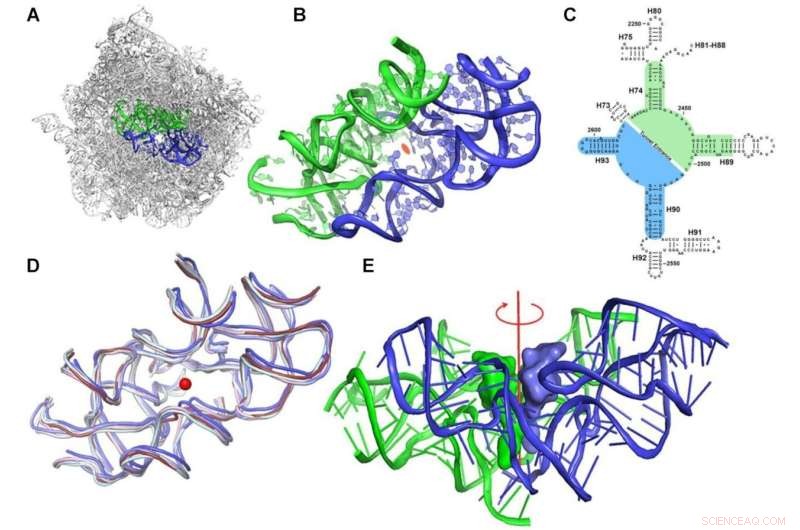
Il concetto di protoribosoma. (A) La regione simmetrica, contrassegnata in blu (A-reg) e verde (P-reg), all'interno dello scaffold di rRNA della grande subunità ribosomiale di D. radiodurans (PDBID 1NKW). (B) Un primo piano del protoribosoma in cui sono mostrate le parti semisimmetriche 2 volte. La vista è lungo l'asse 2 volte pseudo-simmetria. Il centro del PTC è contrassegnato da un'ellisse arancione. (C) Un diagramma della struttura bidimensionale dell'rRNA che circonda il PTC raffigurante la simmetria. I nucleotidi A- e P-reg sono contrassegnati rispettivamente utilizzando sfondi blu e verde. I numeri delle eliche 23S rRNA sono contrassegnati in etichette nere. Viene mostrata la numerazione dei nucleotidi secondo E. coli. (D) Sovrapposizione della regione simmetrica delle strutture ribosomiali di vari organismi rappresentativi di varie classi filogenetiche:batterici (D. radiodurans ed E. coli rispettivamente in ardesia e azzurro), lievito (S. cerevisiae in ciano pallido), parassita ( L. donovani in blu) e ribosomi umani (citosolico e mitocondriale rispettivamente in rubino e rosa chiaro) (PDBID utilizzati sono rispettivamente:1NKW, 4V4Q, 4V7R, 3JCS, 4U60 e 3J7Y). Il punto rosso centrale rappresenta la posizione del presunto asse di simmetria, che è perpendicolare al piano. (E) I tRNA del sito A e del sito P CCA-3 sono stati sovrapposti alla regione simmetrica del ribosoma batterico (PDBID 1NKW). La vista è perpendicolare all'asse semisimmetrico a 2 pieghe, mostrato in rosso. Credito:Ricerca sugli acidi nucleici (2022). DOI:10.1093/nar/gkac052
Questa storia inizia diversi miliardi di anni fa. C'è solo chimica, nessuna biologia, cioè molti composti chimici esistono sulla Terra, ma la vita non è ancora emersa. Quindi, tra le miriadi di strutture chimiche autoassemblate casualmente, una minuscola macchina molecolare dell'RNA si rivela perfettamente adatta per creare legami tra amminoacidi attivati, i mattoni delle future proteine.
È una svolta nella storia del nostro pianeta:ora può iniziare la sintesi delle proteine, molecole biologiche essenziali per la vita. La prof.ssa Ada Yonath e il suo team del Weizmann Institute of Science credono di aver ricreato quel momento in laboratorio, mostrando come sarebbe potuto accadere. Per quanto riguarda la macchina primordiale per la creazione di legami peptidici, hanno scoperto che è ancora presente praticamente in ogni cellula di tutti gli organismi viventi, dai batteri alle piante e agli animali, incluso noi stessi.
La teoria alla base del progetto del team è nata circa 20 anni fa da scoperte sorprendenti fatte nel laboratorio di Yonath nel corso della determinazione della struttura e della funzione del ribosoma, una ricerca che le sarebbe poi valsa il Premio Nobel per la Chimica 2009. Il ribosoma esegue uno dei processi fondamentali della vita:la produzione di proteine basate sulle informazioni nel DNA.
"Abbiamo scoperto una caratteristica sorprendente nella struttura di questa macchina per la produzione di proteine", afferma il dottor Anat Bashan, uno scienziato senior del laboratorio di Yonath nel dipartimento di biologia chimica e strutturale di Weizmann. "Il ribosoma è un'enorme macromolecola per nulla simmetrica; nel suo cuore contiene due elementi semisimmetrici uniti tra loro a formare una tasca."
Yonath dice che "sono rimasti particolarmente colpiti dal fatto che questa tasca si trova nei ribosomi di tutti gli organismi. Ed è qui che si svolge tutta l'azione:è qui che tutti i legami peptidici che creano la catena di amminoacidi collegati che costituiscono una proteina si formano. Ecco perché questo meccanismo di base sembra essere rimasto immutato durante l'evoluzione."
Incontra il protoribosoma:questo è ciò che gli scienziati chiamano questa struttura tascabile. Hanno ipotizzato che il protoribosoma sia l'antenato di tutti i ribosomi moderni, un'antica macchina risalente al periodo previta. In confronto alle dimensioni della cellula, il protoribosoma è piuttosto piccolo. È costituito da molecole di RNA comprendenti circa 120 nucleotidi, circa 60 per ciascuna delle sue due componenti semisimmetriche, che rappresentano meno del 5% delle dimensioni del ribosoma moderno:circa 4.500 nucleotidi nei batteri e quasi 6.000 nell'uomo
Ecco come si è svolto lo scenario, secondo Yonath e il suo team:
Il protoribosoma è nato quando un gruppo di catene nucleotidiche di RNA si è autoassemblato in due pareti semisimmetriche collegate per creare una tasca. Infinite altre strutture devono essersi autoassemblate accidentalmente nello stesso periodo, ma il protoribosoma è sopravvissuto, "diventando virale", a quanto pare, perché ha svolto funzioni utili e, grazie alle capacità intrinseche dell'RNA, potrebbe auto-replicarsi.
Quando due amminoacidi attivati interagivano tra loro all'interno di questa sacca, formavano un legame, facilitato dalle condizioni chimiche prevalenti. Questi amminoacidi potrebbero essere sorti sulla Terra o, come alcuni sostengono, essere atterrati con asteroidi dallo spazio, ma la loro origine è irrilevante per la nostra storia. Ciò che conta è che all'interno del protoribosoma, due amminoacidi attivati potrebbero legarsi tra loro. Successivamente, tale legame ha unito molti più aminoacidi, legandoli in una catena.
Quello fu l'inizio delle proteine, alcune delle quali poi si rivelarono utili per stabilizzare e rafforzare il protoribosoma stesso. Le proteine hanno continuato ad aggiungersi alla struttura del protoribosoma, consentendogli di evolversi nella sofisticata fabbrica di proteine che è oggi. "Un moderno ribosoma può essere descritto come una cipolla, con il protoribosoma al centro, circondato da più strati che sono stati aggiunti durante l'evoluzione", afferma Yonath.
Col tempo, la produzione di proteine diventerebbe abbastanza efficiente da creare catene lunghe fino a migliaia di aminoacidi, e da farlo secondo le istruzioni scritte nel codice genetico. Le decine di migliaia di proteine nel corpo umano svolgono tutte diverse funzioni, dagli ormoni come l'insulina, agli anticorpi nel sistema immunitario, ai componenti strutturali delle cellule e dei tessuti come l'emoglobina o il collagene della pelle. E tutto ebbe inizio con i legami che una volta si formavano per caso all'interno del protoribosoma.
Avanti veloce di qualche miliardo di anni. La teoria era stata confermata da calcoli, deduzioni ed esperimenti di dimerizzazione, in cui gli scienziati hanno creato costrutti dimerici di RNA, imitando il protoribosoma proposto. Ma fino a poco tempo fa, i principi della teoria sono rimasti, beh, in gran parte teorici. Ora, in un nuovo studio condotto dal collega post-dottorato Dr. Tanaya Bose nel laboratorio di Yonath, gli scienziati gli hanno fornito supporto sperimentale.
Bose e colleghi hanno deciso di esplorare se un protoribosoma sintetizzato in laboratorio sarebbe stato sufficientemente stabile per sopravvivere ed eseguire la sua presunta creazione di legami, ovvero volevano scoprire se fosse effettivamente in grado di svolgere questo compito. Lei e gli altri membri del team di Yonath hanno creato un progetto per un potenziale protoribosoma analizzando le strutture a forma di tasca nel cuore di diversi ribosomi batterici. Bose ha quindi preparato questi costrutti protoribosomiche in una piastra da laboratorio.
Poi è arrivato il passaggio cruciale:verificare se i costrutti dimeri tascabili potevano creare legami tra gli amminoacidi. Dopo aver miscelato i costrutti con una soluzione contenente substrati di amminoacidi attivati, nonché vari sali e altri reagenti, Bose ha sottoposto i prodotti della reazione a una batteria di test, inclusa l'analisi di spettrometria di massa.
Per la gioia del team, i protoribosomi sintetici creati in laboratorio sono stati all'altezza del compito. "La formazione del legame peptidico è l'attività più vitale in qualsiasi cellula e abbiamo dimostrato che può aver luogo all'interno di un protoribosoma", afferma Bose.
"Il protoribosoma proposto potrebbe essere l'anello mancante tra un mondo dominato dall'RNA, uno che potrebbe essere esistito prima della comparsa di proteine e DNA, e la vita basata su proteine e acidi nucleici, come la conosciamo oggi", afferma Bashan.
La ricerca è stata pubblicata su Ricerca sugli acidi nucleici . + Esplora ulteriormente